Endometrial cancer – the new challenge of Gynecology Oncology
Cancerul de endometru, sau al corpului uterin, este al doilea cel mai frecvent cancer ginecologic în USA, după cancerul de sân. În România ocupă locul 5 ca incidență în rândul cancerelor la femei și locul 3 în rândul cancerelor ginecologice (dupa cancerul de sân și cel de col uterin). În 2023, conform GLOBOCAN, s-au înregistrat în România 2.282 cazuri noi de cancer endometrial (4,8%) și în același an au decedat 507 femei din cauza acestei afecțiuni (locul 21 în ce privește mortalitatea prin cancer).
Vârsta medie la care este stabilit diagnosticul este 60 ani, dar nimic neobișnuit ca acesta să apară și sub 45 ani. În 69% dintre cazuri diagnosticul este stabilit în stadiu incipient.
Din punct de vedere histologic se descriu două tipuri de cancere ale corpului uterin: carcinomul endometrial, întâlnit în 90% dintre cazuri și sarcomul endometrial, întâlnit în 10% dintre cazuri. Cancerele endometriale prezintă și ele mai multe variante histologice asociate cu un prognostic diferit. Cele mai virulente sunt carcinoamele seroase (4-6% incidență) și cele cu celulă clară (1-2 % incidență). Cele mai comune și cu un prognostic mai bun sunt cancerele endometriale endometrioide (2).
Tradițional, s-au descris două tipuri patogenice de cancer de endometru. Tipul I, cel mai frecvent (80%), întâlnit la femei obeze, cu menopauză tardivă, cu antecente de ovare micropolichistice. Tipul II, mai rar, întâlnit la femei mai tinere, care nu prezintă nici una dintre caracteristicile enumerate la tipul I. Din punct de vedere histologic, tipul I cuprinde carcinoame endometriale endometrioide, în timp ce tipul II cuprinde carcinoamele seroase și cu celulă clară (3).
Cele mai importante simptome ale cancerului de endometru sunt: sângerările uterine anormale – cel mai specific semn în menopauză, durerile pelvine și mărirea uterului.
Diagnosticul este evaluat prin ecografia transvaginală (ETV) și stabilit prin biopsia de endometru, prelevată prin histeroscopie, aspirație endometrială sau curetaj clasic (4).
Stadializarea bolii presupune o evaluare imagistică prin IRM pelvin cu substanță de contrast (pentru evaluarea afectării ganglionare), precum și un CT (torace, abdomen, pelvis) pentru a evalua extensia la distanță.
Tratamentul clasic este cel chirurgical, constând în histerectomie totală cu anexectomie bilaterală. Se poate completa, în funcție de stadiu și tip histologic, cu limfadenectomie pelvină și omentectomie. Ca măsuri terapeutice adjuvante, menționăm radioterapia (externă sau/și brahiterapia), chimioterapia, hormonoterapia și mai nou, imunoterapia.
Prognosticul este favorabil, el depinzând de stadiul bolii și tipul histopatologic si mai recent, este esențial influențat de clasificarea moleculară (5).
Prognosticul este bun în marea majoritatea a cazurilor, supraviețuirea globală la 5 ani fiind de 80%.
 |
 |
 |
 |
Etiologie
Se consideră că la baza apariției cancerului de endometru (CE) stă o stimulare prelungita cu estrogeni (endogeni sau exogeni), fără balansare progesteronică, ducând în timp la hiperplazie endometrială. Aceasta poate fi fără atipii, dar poate progresa în timp către o formă cu atipii: carcinom intraepitelial (neoplazie endometrială intraepitelială – EIN) și apoi carcinom invaziv.
Acest mecanism etiologic este valabil pentru tipul I de cancere endometriale, nu și pentru tipul II.
Factorii de risc pentru cancerul endometrial de tip I sunt: obezitatea, hormonosubstituția cu estrogeni în menopauză, tumorile ovariene secretante de estrogeni, terapia cu tamoxifen, anovulația cronică, menopauza tardivă și menarha precoce. Cancerul de endometru este de 3 ori mai frecvent la femeile obeze.
În ce privește antecedentele heredocolterale, riscul este crescut în cazul existenței în familie a cazurilor de cancer ovarian, endometrial sau colorectal (sindromul Lynch).
Un factor care reduce riscul de cancer de endometru este folosirea contraceptivelor orale estro-progestative, atât ca metodă contraceptivă, cât și ca metodă de reglare a menstrelor în sindromul ovarelor micropolichistice. Utilizarea DIU cu levonorgestrel reduce semnificativ riscul de cancer de endometru.
Riscul de cancer de endometru este mai mic la femeile care au prima sarcină la peste 40 ani (6).
Patofiziologie
Boala debutează ca o leziune preinvazivă (EIN), progresând către un cancer invaziv care penetrează stroma endometrului si apoi miometrul, superficial și profund. Capilarele limfatice, precum și vasele sanguine, sunt și ele invadate, metastazele apărând în ganglionii limfatici regionali pelvini, dar și lombo-aortici. Cancerul se extinde și în suprafața către istm și colul uterin, invazia acestuia din urmă fiind definitorie pentru un stadiu mai avansat de boală.
Prin intermediul vaselor limfatice, sau prin propagare directă, celulele maligne endometriale se extind la trompe și ovare. În formele avansate de boală, CE poate penetra seroasa uterină și chiar organele vecine din pelvis (vezică, rect) sau poate metastaza la distanță.
Anatomie patologică
CE a fost clasificat în două tipuri. Tipul I este considerat un tip de risc scăzut (LG-low grade), cu grad de diferențiere G1-G2, cu invazie miometrială superficială în 69% dintre cazuri și cu prognostic favorabil (supraviețuire globală la 5 ani de 85%).
Tipul II se caracterizează prin G3 în 62% dintre cazuri, invazie miometrială profundă în 65%, metastaze ganglionare pelvine în aproximativ 28% dintre cazuri și prognostic rezervat. Imunohistochimia în aceste cazuri arată prezența unor mutații p53. În categoria aceasta intră formele agresive de carcinoame seroase, cu celulă clară, carcinosarcoamele, carcinoamele mesonephric-like, carcinoamele mucinoase tip gastrointestinal și carcinoamele nediferențiate.
Clasificarea moleculară
În 2013 a fost publicată prima clasificare comprehensivă integrată a CE, prin evaluarea mutațiilor genetice. Această clasificare poate influența semnificativ tratamentul adjuvant postchirurgical al femeilor cu CE agresive (7).
Au fost descrise 4 subtipuri moleculare care stratifică riscul cancerelor de endometru. Acestea sunt: POLE ultramutat (POLEmut), MSI hipermutat (MSI -microsatelite instability high-MSI H; echivalent MMRd- mismatch repair deficiency), p53abn (anomalii p53) si NSMP (no specific molecular profile, adică absența oricaror mutații).
Tumorile cu subtip POLEmut au un prognostic excelent, în timp ce acelea care aparțin subtipului p53abn au un prognostic rezervat. Cancerele cu NSMP și MMRd, cunoscute și ca MSI H(MLH1), au un prognostic intermediar, care este influențat și de statusul receptorilor estrogenici și progesteronici.
OMS (WHO), Societatea Europeană de Ginecologie Oncologică, FIGO și NCCN (National Comprehensive Cancer Network), recomandă încorporarea clasificării moleculare în ghidurile și protocoalele de conduită ale cancerele endometriale. Clasificarea moleculară permite evitarea sub, sau suprastadializării și crează premiza unui tratament corect.
 |
 |
 |
 |
Diagnostic clinic și de laborator
Anamneza va căuta să evidențieze antecedentele familiale de cancer și factorii de risc.
Cel mai important semn clinic este sângerarea uterină anormală, survenită tipic în menopauză, dar și în perioada premenopauzală. Alte simptome (durere pelvină) sunt rar întâlnite. Sângerarea anormală la femeile tinere, supraponderale sau obeze, ori cu sindrom de ovare micropolichistice, va ridica suspiciuni de CE. La fel și terapia de substituție cu estrogeni în menopauză sau tratamentul cu tamoxifen.
Evaluarea unei femei tinere va începe cu un un examen clinic, un test de sarcină și o hemogramă. Examenul clinic va evalua colul și poate include o testare HPVhr și una citologică.
Evaluarea femeii în premenopauză și menopauză se va baza, pe lângă examenul clinic, pe ecografia transvaginală cu evaluarea endometrului. În cazul în care este depistată o hiperplazie endometrială, se va lua decizia de biopsie endometrială (aspirație, curetaj uterin clasic, histeroscopie). Alegerea metodei de biopsie depinde de resursele instituției, cât și de experiența clinicianului. În cazul unei hiperplazii de endometru, consultația făcându-se în cabinet, se va face o aspiratie endometrială. În cazul existenței unor polipi la o femeie multipară, histeroscopia va fi preferată.
În cazul recoltării unui material neconcludent, se va reevalua pacienta prin ecografie transvaginală sau va fi examinată histeroscopic.
Fragmentele extrase se vor examina histopatologic clasic (H& E), imunohistochimic (POLE, MMR, p53) și prin testare genetică, dacă este cazul (secvențiere pentru TP53).
Imagistica
Ecografia transvaginală este un instrument esențial, de prima linie, în diagnosticul CE. Dacă grosimea endometrului este ≤ 5 mm, biopsia endometrială nu este necesară. Dacă totuși sângerarea persistă, este necesară o histeroscopie cu repetarea examenului HP.
Alteori ETV evidențiază o colecție lichidiană endocavitară asociată cu o proeminență endocavitară, sau chiar o formațiune tumorală. Tot ETV permite și evaluarea invaziei miometriale.
Imagistica prin rezonanță magnetică este utilă după aflarea rezultatului HP, pentru evaluarea invaziei miometriale, a colului (stromei) și a ganglionilor limfatici pelvini.
Tomografia computerizată (CT) a toracelui, abdomenului și a pelvisului, cu substanță de contrast, este utilă pentru a evalua existența metastazelor la distanță.
Conduita
Aceasta trebuie individualizată în funcție de vârsta pacientei și a dorinței de fertilitate, tipul histopatologic, stadiul bolii, subtipul molecular, comorbiditățile asociate. Decizia va fi analizata în comisia oncologica și va fi comunicată pacientei (8).
Grupul pentru Ginecologie Oncologica (GOG-USA) a stabilit următoarele criterii de risc ale CE:
- Risc scazut: MMRd sau NSMP pozitiv, cu tumora în stadiul 1 A de boală, cu sau fără invazie vasculo-limfatică sau POLEmut
- Risc intermediar: orice dovadă de invazie miometrială, MMRd sau NSMP pozitiv, stadiul 2 de boală sau mai mic, cu grad 2 sau 3 (se referă la grading-ul adenocarcinoamelor cu diferențiere scuamoasă)
- Risc intermediar înalt: clasificare diferită dupa GOG și PORTEC trial
– PORTEC: > 60 ani, grad 3, invazie miometrială ≥ 50%
– GOG: > 70 ani și mai în vârstă, cu cel puțin un factor de risc; > 50 ani și mai mult, cu > 2 factori de risc; < 50 ani cu > 2 factori de risc - Risc înalt: stadiul 3 de boală, sau carcinom cu celule clare sau seros.
Tratament chirurgical
Tratamentul chirurgical constă în histerectomie totală cu anexectomie bilaterală, cu recomandarea de a fi efectuat pe cale minim invazivă, atunci când resursele materiale și experiența chirurgului o permit. Stadializarea ganglionară este recomandată și ea se face prin identificarea și excizia ganglionului santinelă, atunci când imagistica (IRM) nu indică semne evidente de metastaze ganglionare. Limfadenectomia este recomandată în cazurile de risc intremediar înalt sau risc înalt. În USA limfadenectomia este recomandată și în cazurile de tumori > 2 cm, invazie miometrială > 50%, G3, sau histologie specială (seroasă sau celulă clară). Omentectomia este recomandată în cazul carcinoamelor seroase.
Terapia adjuvantă
Consta în radioterapie și chimioterapie. Se recomandă în cazurile de risc intermediar înalt și înalt.
Radioterapia adjuvantă constă în iradiere externă, ce poate fi asociată sau nu cu brahiterapie.
Chimioterapia adjuvantă se bazează pe folosirea derivaților de platină (carboplatin) și a taxanilor (Paclitaxel).
Hormonoterapia
Se bazează pe folosirea unor doze mari de progesteron, inhibitori de aromatază sau tamoxifen. Se folosesc și în cazul bolii metastatice, deși eficiența lor în aceste cazuri este încă evaluată.
Terapiile țintite
Se bazează pe folosirea checkpoint-inhibitorilor (pembrolizumab, atezolizumab) sau a PARP-inhibitorilor (poly adenosine diphosphate (ADP)-ribose polymerase) de tipul Olaparib.
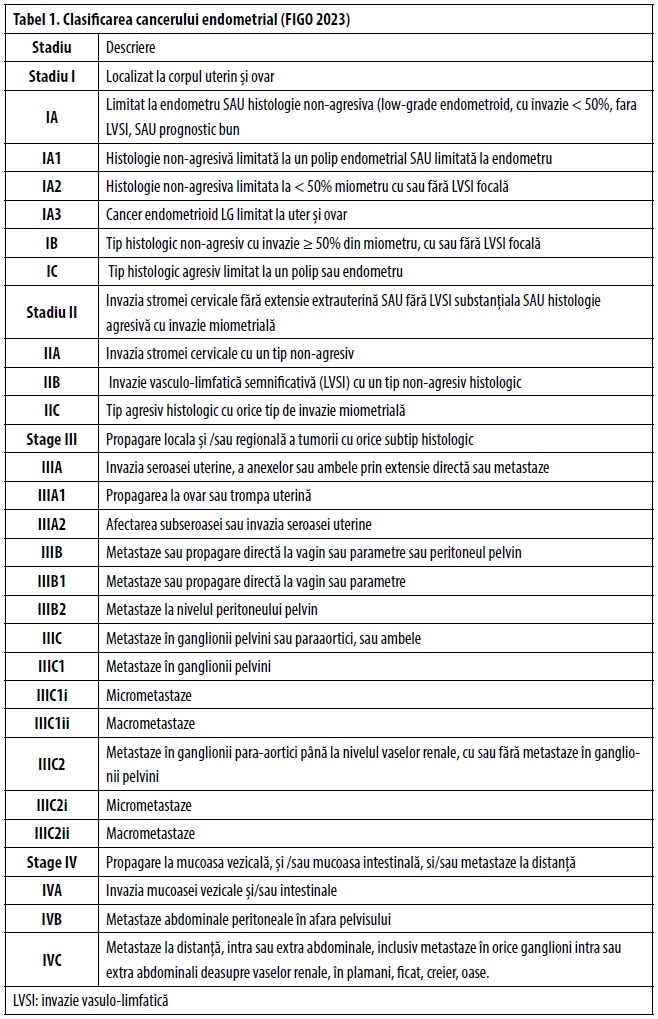
Stadializarea FIGO a cancerului de endometru (2023)
FIGO a stabilit o nouă clasificare stadială în 2023 (Tabel 1) (9). Ea statuează rolul chirurgiei ca element principal al stadializării, alături de informațiile furnizate de examenul histopatologic clasic (tip histopatologic, grad tumoral, invazie vasculo-limfatică) și accentuează importanța identificării subtipului molecular al tumorii pentru corecta stadializare, stratificare a riscului, tratament și prognostic.
Prognostic
Este excelent când boala este depistată în faza incipientă (95% stadiul I, 85% în stadii incipiente). Subtipurile moleculare influențează semnificativ prognosticul. Pacientele cu subtipul molecular POLEmut au o supraviețuire la 5 ani de 98%, în timp ce acelea cu p53abn au o rata de supraviețuire de numai 46,6%. Supraviețuirea fără recidive la 5 ani este de 77,1% pentru subtipul molecular MMRd si 74,4% pentru cele cu NSMP (10).
 |
 |
 |
 |
 |
 |
Bibliografie
1. Globocan. România, 2023.
2. Creasman WT, Odicino F, Maisonneuve P, Quinn MA, Beller U, Benedet JL, Heintz A, Ngan H, Pecorelli S. Carcinoma of the Corpus Uteri. Int J Gynaecol Obstet. 2006 Nov;95 Suppl 1:S105-S143.
3. Bohman JV. Two Patogenetic Types of Endometrial Cancer. Gynecol Oncol 1983.
4. Makker V, MacKay H, Ray-Coquard I, Levine DA, Westin SN, Aoki D, Oaknin A. Endometrial cancer. Nat Rev Dis Primers. 2021 Dec 09;7(1):88.
5. Walsh CS, et al. Molecular testing for endometrial cancer: An SGO clinical practice statement. Gynecol Oncol 2023;48:55.
6. Howitt BE, Hanamornroongruang S, Lin DI, Conner JE, Schulte S, Horowitz N, Crum CP, Meserve EE. Evidence for a dualistic model of high-grade serous carcinoma: BRCA mutation status, histology, and tubal intraepithelial carcinoma. Am J Surg Pathol. 2015 Mar;39(3):287-93.
7. Levine DA. Cancer Genomic Atlas Research Network (TGCA). Integrated genomic characterization of endometrial carcinoma. Nature, 497(7447):67-73, 2013.
8. NCCN Guidelines. Version 1. 2025
9. Berek J, et al. FIGO staging of endometrial cancer. J Gynecol Oncol, 2023;34(5):e85.
10. Oaknin A, Bosse TJ, Creutzberg CL, Giornelli G, Harter P, Joly F, Lorusso D, Marth C, Makker V, Mirza MR, Ledermann JA, Colombo N., ESMO Guidelines Committee. Electronic address: clinicalguidelines@esmo.org. Endometrial cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Ann Oncol. 2022 Sep;33(9):860-877.
 Prof. Univ. Dr. Gheorghe Peltecu
Prof. Univ. Dr. Gheorghe Peltecu