Abstract
Ultrasound-based elastography techniques (VCTE, pSWE and 2D-SWE) are recommended by all current international guidelines as the preferred approach for evaluating diffuse liver diseases in clinical practice. Beyond their well-established role in diagnosing and staging chronic liver disease, they also hold prognostic value, by allowing the prediction of vascular and/or oncological complications.
Optimal patient assessment depends on the correct implementation of these methods and on a thorough understanding of the factors that may influence result interpretation.
Introducere
Patologia hepatică, a 11-a cauză principală de mortalitate şi respectiv a 15-a cauză principală de morbiditate, reprezintă o problemă importantă de sănătate publică, fiind responsabilă de aproximativ 2 milioane de decese la nivel mondial[1].
Din punct de vedere histologic, afecţiunile hepatice pot fi caracterizate prin cuantificarea activităţii inflamatorii, a gradului de încărcare grasă al hepatocitelor (steatoză) şi a stadiului fibrozei hepatice. Deşi biopsia hepatică este considerată încă standardul de aur pentru diagnosticul bolilor hepatice, aceasta prezintă o serie de limitări, precum natura invazivă a metodei, posibilele erori de eşantionare, variabilitatea inter-observator şi accesul limitat în practica curentă [2].
Tehnicile secţionale, precum ultrasonografia, computer-tomografia şi imagistica prin rezonanţă magnetică au rol predominant în diagnosticul de boală hepatică avansată în stadiu cirotic, prin detectarea semnelor imagistice clasice (de ex. conturul neregulat al ficatului, dismorfismul hepatic), respectiv în detectarea precoce a posibilelor complicaţii vasculare şi/sau oncologice. Aceste metode au, însă, sensibilitate redusă în diagnoza stadiilor precirotice ale bolii. Avansul tehnologic din ultimele decenii a permis dezvoltarea unor tehnici imagistice capabile să cuantifice într-o manieră non-invazivă şi cu performanţe foarte bune principalele trăsături ale bolilor hepatice, iar dintre acestea, din punct de vedere clinic, componenta fibrotică are implicaţii prognostice importante, fiind strâns legată de apariţia hipertensiunii portale. Acest eveniment marchează trecerea spre un stadiu al bolii hepatice cu risc mare de apariţie a complicaţiilor cirozei, ce impune implementarea profilaxiei şi monitorizarea îndeaproape a acestor pacienţi [3,4].
Dintre tehnicile neinvazive de evaluare a bolilor hepatice, un rol important îl au cele elastografice.
Tehnici elastografice utile în evaluarea hepatopatilor difuze
Elastografia este tehnica ce permite evaluarea neinvazivă a proprietăţilor biomecanice ale unui ţesut, definind astfel rezistenţa unui țesut la o forță externă aplicată. La nivel tisular, anumite modificări patologice (de ex. fibroza, inflamaţia) pot induce o creştere a rigidităţii acelui ţesut, aspect ce poate fi detectat şi cuantificat prin tehnicile elastografice. Elastografia hepatică se poate împărți în două mari categorii: elastografia ultrasonografică şi elastografia pe bază de imagistică prin rezonanţă magnetică (Magnetic resonance elastography, MRE)[5].
Datorită accesibilităţii si costului mai redus, cele mai utilizate în practica clinică curentă sunt tehnicile elastografice ultrasonografice, anume elastografia tranzitorie unidimensională (VCTE, „vibration controlled transient elastography”) realizată cu echipamentul Fibroscan® (Echosens, Paris), pSWE (point shear-wave elastography) şi 2D-SWE (2D shear-wave elastography), ultimele două fiind integrate în echipamentele ecografice moderne. Principalele caracteristici ale tehnicilor elastografice sunt prezente în Tabelul 1.

Conform ghidurilor în vigoare, orice examinare elastografică hepatică trebuie să se realizeze la minim 4 ore postprandial, respectiv după o perioadă de odihnă de cel puţin 10 minute, întrucât alimentarea recentă sau efortul fizic efectuat înainte de examinare pot duce la falsa creştere a rigidităţii hepatice (RH)[4].
Pe de altă parte, orice tehnică elastografică trebuie interpretată în contexul clinic şi biochimic al pacientului, întrucât colestaza, citoliza, congestia, hemodializă sau chiar steatoza severă pot influenţa rigiditatea hepatică, supraestimând stadiul de fibroză [5,6]. Principalele limitări tehnice şi avantajeale tehnicilor elastografice sunt prezentate în Tabelul 2.

În prezent, tot mai multe echipamente ultrasonografice dispun de softuri de elastografie şi nu doar „vârfurile de gamă”, realizând aşa numita „ecografie multiparametrică’’. Atfel, prin integrarea unor module specifice, se realizează cu acelaşi echipament ecografia în scară gri, ecografia doppler, ecografia cu contrast, precum şi evaluarea elastografică a fibrozei, a steatozei si posibil, a inflamației hepatice [8].
Rolul elastografiei ultrasonografice în evaluarea hepatopatiilor difuze
Interpretarea valorii rigidității hepatice
Etiologia afecţiunilor hepatice este diversă, cea mai ridicată prevalenţă având boala hepatică steatotică asociată disfuncţiilor metabolice – MASLD, „Metabolic Dysfunction-associated Steatotic Liver Disease”, hepatitele virale şi boala hepatică asociată consumului de alcool (ALD, ,,Alcohol-Associated Liver Disease’’) [9].
Utilizarea testelor hepatice neinvazive imagistice este ferm recomandată în cazul hepatitelor virale şi a MASLD. Cercetările privind utilizarea acestora în ALD, respectiv în boala hepatică colestatică nu sunt la fel de exhaustive, prin urmare interpretarea rezultatelor la aceşti pacienţi trebuie realizată cu precauţie, ţinându-se cont mereu de posibilul efect al episoadelor de acutizare şi/sau al prezenţei obstrucţiei biliare asupra rigiditatii hepatice [5].
Cel mai important factor prognostic la pacienţii cu hepatopatii cronice este stadiul fibrozei hepatice. Din punct de vedere histologic, există scoruri de stadializare pentru fiecare etiologie în parte. Din punct de vedere clinic însă, pentru standardizarea şi implementare mai facilă în practică, sunt importante 3 momente: stadiul de fibroză semnificativă (≥F2), de fibroză avansată (≥F3), respectiv stadiul de ciroză (F4).
Studiile privind stadializarea fibrozei hepatice cu ajutorul elastografiei au evidențiat valori cutoff diferite în funcție de etiologie şi chiar şi în funcție de tipul de aparat. Ca urmare, consensul Baveno VI, ulterior extins în Baveno VII, a propus utilizarea unor valori prag unice în cazul măsurătorilor VCTE la pacienţii cu hepatopatii virale, ALD şi MASLD non-obezi, cunoscute sub numele de ,,regula lui 5’’(Tabel 3) [4,10].
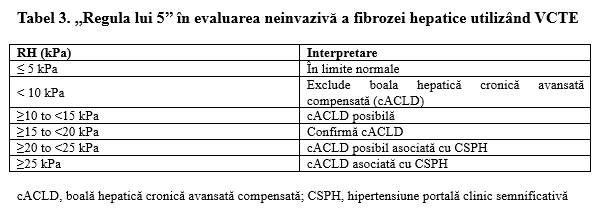
Aceste valori au, de asemenea, un rol prognostic prin predicţia riscului de hipertensiune portală clinic semnificativă (CSPH) (gradient de presiune venoasă hepatică HVPG >10mmHg) la pacienţii cu boală hepatică cronică avansată compensată (cACLD). În plus, modelul ANTICIPATE, bazat pe RH şi numărul de trombocite, stratifică ulterior acest risc, astfel: RH între 20 și 25 kPa asociată cu numărul de trombocite <150 × 10⁹/L sau RH între 15 și 20 kPa asociată cu numărul de trombocite <110 × 10⁹/L indică un risc de cel puțin 60% de a avea CSPH [11]. Pentru boala hepatică cronică avansată compensată de etiologie MASLD, există un model de predicţie a riscului CSPH similar, modelul ANTICIPATE-NASH, ce include pe lângă RH şi numărul de trombocite şi indicele de masă corporal (IMC) [12].
În plus, ghidul Baveno VII, precizează faptul că, la pacienţii cu hepatopatii virale, ALD şi MASLD non-obezi, dacă la VCTE rigiditatea hepatică este sub 20 kPa și trombocitele sunt normale (≥150 × 10⁹/L), respectiv rigiditatea splenică este sub 40 kPa, acel pacient are un risc foarte scăzut de varice cu risc crescut, iar endoscopia digestivă superioară poate fi evitată [3].
Un studiu multicentric realizat ulterior pe o cohortă mare de pacienţi a evidenţiat faptul că pentru etiologiile MASLD şi ALD, valorile prag de 8 kPa şi 12 kPa sunt mai potrivite decât cele de 10 kPa, respectiv 15 kPa din ,,regula lui 5’’ ca praguri ce exclud sau confirmă prezenţa unei boli hepatice cronice avansate compensate [13].
În ceea ce priveşte utilizarea tehnicilor p-SWE şi 2D-SWE, studiile au arătat că diferenţele dintre sistemele ecografice şi valorile prag ale diferiţilor producători sunt neglijabile şi s-a propus utilizarea în practica curentă a următoarelor valori prag, cunoscute sub numele de ,,regula lui 4’’, aplicabile indiferent de etiologia afecţiunii hepatice (Tabel 4) [14].
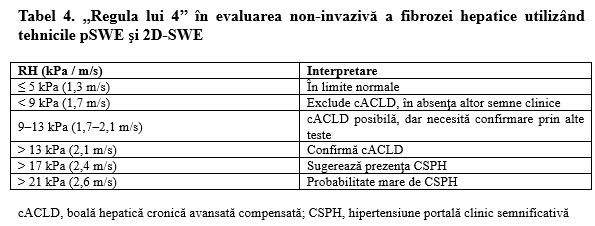
Trebuie subliniat însă că tehnicile elastografice ultrasonografice nu se recomandă pentru evaluarea regresiei fibrozei hepatice după tratament. Având în vedere că RH poate fi influenţată şi de inflamaţia hepatică pe lângă fibroză, nu există suficiente dovezi că evoluţia RH după iniţierea tratamentului se corelează cu acuratețe doar cu modificările histologice fibrotice.
Particularităţi ale utilizării elastografiei ultrasonografice în cele mai frecvente hepatopatii difuze
- Boala hepatică steatotică asociată disfuncţiilor metabolice (MASLD, Metabolic dysfunction-associated steatotic liver disease)
În MASLD testele neinvazive au rol în diagnosticul bolii, în evaluarea severităţii afectării hepatice, precum şi în stratificarea riscului de evenimente hepatice şi de mortalitate al acestor pacienţi. Detectarea fibrozei avansate este extrem de importantă, fiind principalul factor ce predispune la apariţia complicaţiilor [15].
Diagnosticul de MASLD ar trebui suspectat şi evaluat în cazul pacienţilor cu diabet zaharat de tip 2, obezitate abdominală asociată cu cel puţin un factor de risc cardiometabolic adiţional (de ex. dislipidemie) sau cu probe hepatice alterate, la care se exclude consumul de alcool [16].
Primul pas în demersul diagnostic al MASLD este reprezentat de confirmarea şi cuantificarea gradului de steatoză hepatică. Ecografia în scară de gri poate fi utilizată pentru screeningul steatozei, dar are sensibilitate și specificitate redusă. Parametrul de atenuare controlată (CAP) măsurat cu VCTE poate fi folosit ca test de primă intenţie, cu menţiunea că poate există o suprapunere a valorilor CAP între gradele adiacente de steatoză şi pe de altă parte, sensibilitatea nu este suficient de mare pentru evaluarea modificărilor de la nivel hepatic postintervenţii terapeutice. Ghidul american recomandă o valoare prag a CAP ≥275 dB/m pentru detectarea steatozei în MASLD (>5% încărcare grasă hepatocitară) [5]. În continuă cercetare şi validare sunt şi markerii ultrasonografici elastografici (coeficientul de atenuare, backscatter şi viteza sunetului) integraţi în echipamentele ecografice moderne [6] .
Tehnicile IRM (MRI-PDFF, Magnetic Resonance Imaging Proton Density Fat Fraction şi MRS, magnetic resonance spectroscopy) sunt actualmente considerate cele mai precise metode pentru cuantificarea şi evaluarea răspunsului la tratamentul steatozei hepatice, fiind superioare tehnicilor ultrasonografice[7]. Cu toate acestea, o meta-analiză recentă a arătat ca valorile MRI-PDFF nu se corelează liniar cu procentul histologic de conţinut lipidic hepatocitar pe întregul spectru al gradelor de steatoză hepatică [17]. În plus, aceste metode sunt limitate de accesibilitatea redusă şi costul înalt. Un alt aspect important de menţionat este faptul că lipsa steatozei la un pacient cu fibroză avansată sau ciroză nu exclude MASLD ca si cauza a hepatopatiei.
Evaluarea severităţii afectării hepatice în MASLD
- Detectarea steatohepatitei non-alcoolice la risc (at risk MASH)
Scorul FAST se bazează pe valoarea CAP şi a aspartat aminotransferazei (AST) şi detecteză cu acurateţe de peste 80% subpopulaţia de pacienţi cu steatohepatită la risc (caracterizată din punct de vedere histologic printr-un scor de acitivitate ≥ 4 puncte şi cel puţin stadiul de fibroză semnificativă ≥F2 ). Acest aspect este foarte important, întrucât aceşti pacienţi ar putea beneficia de terapie farmacologică (Resmeriton, medicament aprobat recent de FDA), adiţional măsurilor de schimbare a stilului de viaţă. Scoruri similare există şi pentru metoda IRM, de exemplu scorul MAST (MRE + MRI-PDFF + AST) sau MEFIB (MRE + FIB-4)[16].
2.Evaluarea fibrozei hepatice în MASLD
Pentru evaluarea stadiului de fibroză hepatică la pacienţii cu MASLD se recomandă o abordare multistadială. Primul pas constă în utilizarea unor teste serologice simple, cu cost redus, ce ar putea fi implementate în cabinetul medicului de familie (de ex. scorul FIB-4) . Rolul principal este de a exclude prezenţa unei fibroze avansate. În cazul în care suspiciunea diagnostică persistă (de ex. FIB-4>1.3), se impune completarea cu un al doilea test, într-un centru specializat, cu scop de confirmare a prezenţei fibrozei avansate. Cele mai frecvent utilizate teste în acest sens sunt testele elastografice ultrasonografice.
Meta-analize recente au evidenţiat faptul că toate tehnicile elastografice ultrasonografice (p-SWE, 2D-SWE, VCTE) au performanţe comparabile, acceptabile spre foarte bune, în stadializarea fibrozei hepatice din MASLD, cu AUROC de 0.75-0.86 pentru fibroza semnificativă, respectiv 0.8-1.0 pentru fibroza avansată şi ciroză. MRE are performanţă comparabilă sau superioară faţă de tehnicile elastografice ultrasonografice în stadializarea fibrozei hepatice, iar dacă este disponibilă, se recomandă a fi utilizată în cazurile în care pacienţii necesită tehnici de imagistică secţională sau dacă celelalte tehnici nu pot fi efectuate[5].
La pacienţii cu MASLD o valoare a rigidităţii hepatice la VCTE < 8 kPa exclude fibroza avansată, iar o valoare >12 kPa confirmă prezenţa acesteia.
Metodele elastografice au valoare prognostică, putând prezice riscul de apariţie al evenimentelor hepatice, precum şi riscul de mortalitate. Astfel, la pacientii cu MASLD avansată în stadiu compensat, rigiditatea hepatică iniţială s-a dovedit a fi factor de risc independent pentru dezvoltarea hepatocarcinomului şi pentru decompensarea hepatică (,,regula lui 5’’ şi modelul ANTICIPATE-NASH dacă se utilizează VCTE, respectiv ,,regula lui 4’’ dacă se utilizează p-SWE sau 2D-SWE) [4].
La pacienţii cu fibroză avansată sau ciroză MASLD, regresia fibrozei se asociază cu reducerea riscului de evenimente hepatice, însă nu s-a demonstrat o reducere a mortalităţii. În funcţie de riscul individual, ghidul european recomandă reevaluarea pacienţilor la 1-3 ani, evaluarea anuală fiind sugerată pacienţiilor cu ACLD [16].
Limitări specifice ale tehnicilor elastografice în MASLD
În cazul MASLD, limitările specifice ale tehnicilor elastografice sunt reprezentate în principal de obezitatea abdominală, distanţa tegument-capsulă hepatică şi prezenţa steatozei severe. În majoritatea cazurilor cu distanţă tegument-capsulă hepatică ≥25 mm, evaluarea VCTE cu o sondă XL poate remedia eșecul măsurării RH, însă nu şi în cazul obezităţii morbide (IMC ≥40 kg/m²). Obezitatea poate afecta, într-o măsură mai redusă, şi măsurătorile efectuate cu tehnicile SWE sau MRE.
Deși impactul clinic nu este clar încă, steatoza severă pare să ducă la cresterea valorii rigiditatii hepatice cu supraestimarea conscutiva a stadiului de fibroză hepatică, dar studiile sunt inca destul de contradictorii [6,7].
- Hepatite virale B şi C
Diagnosticul hepatitelor virale B şi C se realizează serologic prin evidenţierea markerilor specifici, iar testele hepatice imagistice neinvazive au rolul de a evalua severitatea afectării hepatice, de a evalua oportunitatea de iniţiere a tratamentului (în infecţia cu virus B), precum şi în stratificarea riscului de apariție a unor evenimente hepatice şi de mortalitate.
Toate tehnicile elastografice ultrasonografice (p-SWE, 2D-SWE, VCTE) au performanţe comparabile, foarte bune spre excelente, în stadializarea fibrozei hepatice din hepatopatiile virale, în special în detectarea stadiului de ciroză hepatică. Tehnicile elastografice au performananţe similare cu scorurile serologice (de ex. APRI) în detectarea fibrozei semnificative, dar sunt superioare acestora în stadiile avansate[18].
Asadar, evaluarea iniţială a stadiului fibrozei hepatice poate fi efectuată prin teste serologice (APRI sau FIB4) sau elastografice, iar la pacienţii cu ciroză anterior de tratament, se recomandă supraveghere pe termen lung pentru depistarea hepatocarcinomului (HCC).
Iniţierea tratamentului antiviral
Recomandările OMS actualizate în anul 2024 privind tratamentul hepatitei cronice virale B au presupus extinderea criteriilor de eligibilitate la tratament. Astfel, în prezent, pentru toți adulții și adolescenții ≥12 ani, inclusiv femei însărcinate şi fete la vârstă reproductivă, există patru criterii principale, dintre care doar unul necesită testarea viremiei B (ADN-VHB). Testele neinvazive imagistice hepatice au rol în cadrul unuia dintre criterii: detectarea unui stadiu cel puţin de fibroză semnificativă ≥ F2 (prin scor APRI >0,5 sau prin RH măsurată cu ajutorul VCTE >7 kPa) sau de ciroză (pe baza criteriilor clinice, a unui scor APRI >1,0 sau a unei valori a RH măsurată cu ajutorul VCTE >12,5 kPa), indiferent de ADN-VHB sau valoarea alanin-aminotransferazei (ALT) impune iniţierea tratamentului antiviral [19].
Menţionăm faptul că aceste teste nu au fost validate pentru copii, iar valorile rigidităţii hepatice amintite anterior sunt valori medii ale intervalelor 6-8 kPa şi 11-14 kPa, pentru diagnosticul fibrozei semnificative, respectiv al cirozei. Un alt aspect important este faptul că VCTE poate fi utilizată în sarcină (aprobată de FDA în anul 2023)[19].
Spre deosebire de hepatita cronică virală B, tratamentul în hepatita virală C se administrează pe durată limitată şi are eficienţă crescută, determinând o rată de răspuns de peste 95%. Prin urmare, se recomandă iniţierea tratamentului cu medicaţie antivirală la toţi pacienţii cu infecţie dobândită recent sau cronică, indiferent de stadiul fibrozei. Cu toate acestea, se recomandă o evaluare iniţială a severităţii afectării hepatice şi tratamentul urgent trebuie luat în considerare la pacienţii cu fibroză cel puţin semnificativă, inclusiv la cei cu ciroză, indiferent de statusul compensat/decompensat [20].
Regresia cirozei este bine recunoscută la majoritatea pacienților cu hepatită cronică virală B cu supresie virală completă și la pacienții cu hepatită cronică virală C care au obținut răspuns virologic susținut (RVS). Cu toate acestea, ghidul european recomandă continuarea supravegherii acestor pacienţi, chiar dacă se constată scăderea rigidităţii hepatice la evaluări seriate posttratament, riscul lor de dezvoltare al HCC rămânând crescut [20] .
În ceea ce priveşte pacienţii cu infecţii cronice virale B sau C şi stadiu avansat de fibroză hepatică (F3), noul ghid european de management al HCC nu recomandă efectuarea de rutină a supravegherii dezvoltării HCC, din cauza dovezilor insuficiente ca raport cost-beneficiu [21].
Utilizarea valorii rigidităţii hepatice ca marker al răspunsului la tratament la aceşti pacienţi este controversată. În hepatita virală cronică, aceasta este influențată nu doar de fibroză, ci și de inflamația de la nivel hepatic. Din acest motiv, scăderea rigidităţii hepatice în timpul și după terapia antivirală, în special în fazele timpurii, reflectă mai degrabă reducerea inflamației hepatice decât o regresie reală a fibrozei [5,6].
Ghidul european nu recomandă utilizarea testelor noninvazive pentru detectarea regresiei fibrozei după RVS la pacienții cu virus C, care au fost diagnosticați cu cACLD înainte de terapia antivirală. Cu toate acestea, până la noi cercetări în această direcţie şi având în vedere specificitatea ridicată a metodelor, se poate considera că pacienţii cu o valoare a rigidităţii hepatice >12 kPa după RVS au o probabilitate mare de a avea cACLD persistentă [7].
Criteriile Baveno VII menţionate anterior au fost validate recent şi pentru pacienții cu ciroză virală B sub terapie antivirală. În plus, la ciroza de cauză virală C, atingerea unui rigidităţi hepatice <12 kPa și a unui număr normal de trombocite după RVS exclude hipertensiunea portală clinic semnificativă (CSPH) [4,5].
Limitări specifice ale tehnicilor elastografice în hepatitele virale
Limitările specifice în cazul evaluării elastografice la pacienţii cu hepatite virale se referă la interpretarea rezultatelor la persoanele cu puseuri acute de hepatită, care vor avea valori fals crescute ale rigidității hepatice [5].
III. Boala hepatică asociată consumului de alcool
În cadrul unei boli hepatice steatotice, în lipsa asocierii unor factori cardiometabolici, documentarea unui consum moderat de alcool de >20 g/zi la femei și >30 g/zi la bărbați ridică suspiciunea unei boli hepatice asociate consumului de alcool (ALD). În prezenţa factorilor cardiometabolici, un consum moderat de alcool determină o entitate diagnostică mixtă, anume MASLD asociată cu un consum moderat de alcool (MetALD, ,,Metabolic and Alcohol-related Liver Disease’’), iar un consum excesiv de alcool (>50 g/zi la femei și >60 g/zi la bărbați) stabileşte diagnosticul de ALD [16].
Ghidurile sugerează utilizarea cu precauţie a testelor neinvazive hepatice imagistice pentru stadializarea fibrozei hepatice la pacienţii cu ALD. Conform unei meta-analize recente, valorile crescute ale aspartat-aminotransferazei (AST) și ale bilirubinei sunt direct asociate cu valorile rigidităţii hepatice în ALD. Astfel, la pacienții cu consum neîntrerupt de alcool, măsurarea rigidităţii hepatice trebuie repetată după cel puțin 1 săptămână (conform ultimului ghid european) sau 4 săptămâni (conform ultimului ghid WFUMB) de abstinență, dacă există semne concomitente de activitate inflamatorie (sindrom de hepatocitoliză AST >70 U/L și/sau bilirubină crescută) [5, 22].
Cercetările sunt mai limitate în etiologia ALD, dar au arătat performanţe foarte bune spre excelente pentru toate tehnicile elastografice ultrasonografice, cu sensibilitate crescută în special în diagnosticul stadiilor mai avansate de fibroză [23].
Dacă se utilizează VCTE, valorile rigidităţii hepatice <8 kPa exclud fibroza hepatică avansată, iar valorile >12 kPa confirmă fibroza avansată. pSWE și 2D-SWE pot fi utilizate în scop diagnostic la pacienții cu ALD, deoarece acuratețea lor este comparabilă cu cea a VCTE. În absența unui consens asupra valorilor prag în ceea ce priveste tehnicile pSWE si 2D-SWE, poate fi avută în vedere „regula de 4” pentru stadializarea fibrozei [14].
Rigiditatea hepatică măsurată prin VCTE poate fi utilizată şi pentru a prezice evenimentele hepatice la pacienții cu ALD și boală compensată (,,regula lui 5’’şi modelul ANTICIPATE). O valoarea iniţială mai mare de 15 kPa la pacienţii cu boală compensată se corelează cu un risc mai mare de complicaţii şi de deces [4].
Având în vedere coexistenţa frecventă a steatozei hepatice la pacienţii cu etiologie etanolică, se recomanda utilizarea CAP sau a tehnicilor elastografice implementate pe echipamente ultrasonografice pentru cuantificarea gradului de steatoză hepatică la aceşti pacienţi. La fel ca şi în cazul MASLD, ghidul american recomandă o valoare prag a CAP ≥275 dB/m pentru detectarea steatozei (>5% încărcare grasă hepatocitară) [6].
Concluzie
Elastografia ultrasonografică cu toate tehnicile disponibile (VCTE, pSWE și 2D-SWE) este, în prezent, o metodă indispensabilă în evaluarea neinvazivă a hepatopatiilor difuze, cu utilitate demonstrată în diagnosticul şi stadializarea fibrozei, în stratificarea riscului prognostic, dar şi în estimarea steatozei şi, posibil, a inflamaţiei.
Elastografia a devenit parte integrantă din protocolul de examinare ecografică, iar pentru o evaluare optimă este important ca tehnica să se realizeze corect, iar interpretarea rezultatelor să se facă de un medic cu experienţă, intotdeauna în context clinic, luând în considerare atât parametrii demografici, cât și analizele de laborator.
Bibliografie
- Devarbhavi H, Asrani SK, Arab JP, Nartey YA, Pose E, Kamath PS. Global burden of liver disease: 2023 update. J Hepatol. 2023 Aug;79(2):516-537. doi: 10.1016/j.jhep.2023.03.017.
- Chowdhury AB, Mehta KJ. Liver biopsy for assessment of chronic liver diseases: a synopsis. Clin Exp Med. 2023 Jun;23(2):273-285. doi: 10.1007/s10238-022-00799-z. Epub 2022 Feb 22.
- Angulo P, Kleiner DE, Dam-Larsen S, et al. . Liver Fibrosis, but No Other Histologic Features, Is Associated With Long-term Outcomes of Patients With Nonalcoholic Fatty Liver Disease. Gastroenterology. 2015 ;149(2):389-97.e10. doi: 10.1053/j.gastro.2015.04.043.
- de Franchis R, Bosch J, Garcia-Tsao G, Reiberger T, Ripoll C; Baveno VII Faculty. Baveno VII – Renewing consensus in portal hypertension. J Hepatol. 2022;76(4):959-974. doi: 10.1016/j.jhep.2021.12.022. 5. Ferraioli G, Barr RG, Berzigotti A, et al.. WFUMB Guideline/Guidance on Liver Multiparametric Ultrasound: Part 1. Update to 2018 Guidelines on Liver Ultrasound Elastography. Ultrasound Med Biol. 2024;50(8):1071-1087. doi: 10.1016/j.ultrasmedbio.2024.03.013.
- Sterling RK, Duarte-Rojo A, Patel K, et al. . AASLD Practice Guideline on imaging-based noninvasive liver disease assessment of hepatic fibrosis and steatosis. Hepatology. 2025;81(2):672-724. doi: 10.1097/HEP.0000000000000843.
- European Association for the Study of the Liver. EASL Clinical Practice Guidelines on non-invasive tests for evaluation of liver disease severity and prognosis – 2021 update. J Hepatol. 2021;75(3):659-689. doi: 10.1016/j.jhep.2021.05.025.
- Ferraioli G, Barr RG, Berzigotti A, et al. . WFUMB Guidelines/Guidance on Liver Multiparametric Ultrasound. Part 2: Guidance on Liver Fat Quantification. Ultrasound Med Biol. 2024;50(8):1088-1098. doi: 10.1016/j.ultrasmedbio.2024.03.014.
- Rinella ME, Lazarus JV, Ratziu V, et al.; NAFLD Nomenclature consensus group. A multisociety Delphi consensus statement on new fatty liver disease nomenclature. Hepatology. 2023;78(6):1966-1986. doi: 10.1097/HEP.0000000000000520.
- de Franchis R; Baveno VI Faculty. Expanding consensus in portal hypertension: Report of the Baveno VI Consensus Workshop: Stratifying risk and individualizing care for portal hypertension. J Hepatol. 2015;63(3):743-52. doi: 10.1016/j.jhep.2015.05.022.
- https://www.bcn-liverhuvh.com/resources
- Pons M, Augustin S, Scheiner B, et al. . Noninvasive Diagnosis of Portal Hypertension in Patients With Compensated Advanced Chronic Liver Disease. Am J Gastroenterol. 2021;116(4):723-732. doi: 10.14309/ajg.0000000000000994.
- Papatheodoridi M, Hiriart JB, Lupsor-Platon M, et al. Refining the Baveno VI elastography criteria for the definition of compensated advanced chronic liver disease. J Hepatol. 2021;74(5):1109-1116. doi: 10.1016/j.jhep.2020.11.050.
- Barr RG, Wilson SR, Rubens D, Garcia-Tsao G, Ferraioli G. Update to the Society of Radiologists in Ultrasound Liver Elastography Consensus Statement. Radiology. 2020;296(2):263-274. doi: 10.1148/radiol.2020192437. .
- Anstee QM, Lawitz EJ, Alkhouri N, et al. . Noninvasive Tests Accurately Identify Advanced Fibrosis due to NASH: Baseline Data From the STELLAR Trials. Hepatology. 2019;70(5):1521-1530. doi: 10.1002/hep.30842.
- European Association for the Study of the Liver (EASL); European Association for the Study of Diabetes (EASD); European Association for the Study of Obesity (EASO). EASL-EASD-EASO Clinical Practice Guidelines on the management of metabolic dysfunction-associated steatotic liver disease (MASLD). J Hepatol. 2024;81(3):492-542. doi: 10.1016/j.jhep.2024.04.031.
- Qadri S, Vartiainen E, Lahelma M, et al. . Marked difference in liver fat measured by histology vs.magnetic resonance-proton density fat fraction: A meta-analysis. JHEP Rep. 2023;6(1):100928. doi: 10.1016/j.jhepr.2023.100928.
- European Association for the Study of the Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatol. 2017;67(2):370-398. doi: 10.1016/j.jhep.2017.03.021.
- World Health Organization. Guidelines for the Prevention, Diagnosis, Care and Treatment for People with Chronic Hepatitis B Infection (Text Extract): Executive Summary. Infect Dis Immun. 2024;4(3):103-105. doi: 10.1097/ID9.0000000000000128.
- European Association for the Study of the Liver. Electronic address: easloffice@easloffice.eu; Clinical Practice Guidelines Panel: Chair:; EASL Governing Board representative:; Panel members:. EASL recommendations on treatment of hepatitis C: Final update of the series☆. J Hepatol. 2020;73(5):1170-1218. doi: 10.1016/j.jhep.2020.08.018.
- European Association for the Study of the Liver. EASL Clinical Practice Guidelines on the management of hepatocellular carcinoma. J Hepatol. 2025;82(2):315-374. doi: 10.1016/j.jhep.2024.08.028
- European Association for the Study of the Liver. EASL Clinical Practice Guidelines: Management of alcohol-related liver disease. J Hepatol. 2018;69(1):154-181. doi: 10.1016/j.jhep.2018.03.018.
- Crabb DW, Im GY, Szabo G, Mellinger JL, Lucey MR. Diagnosis and Treatment of Alcohol-Associated Liver Diseases: 2019 Practice Guidance From the American Association for the Study of Liver Diseases. Hepatology. 2020;71(1):306-333. doi: 10.1002/hep.30866.
 Prof. Dr. Monica Lupșor Platon
Prof. Dr. Monica Lupșor Platon





