Cancerul colorectal (CCR) a reprezentat în 2020 a doua cea mai frecvent diagnosticată neoplazie la nivel European, iar în România a doua cauză de mortalitate prin cancere (1,2). CCR este o afecțiune ce poate fi prevenită prin screeningul colonoscopic și prin rezecția leziunilor precursoare. După implementarea programelor de screening, s-a înregistrat scăderea numărului de cazuri diagnosticate la persoanele de peste 50 ani. În ultimele decenii însă, în țările vestice, a crescut incidența cazurilor diagnosticate la vârste tinere, sub 50 ani – early-onset colorectal cancer (EOCRC), asociind totodată o mortalitate în creștere (3).
Bolile inflamatorii intestinale (BII) – boala Crohn și colita ulcerativă, reprezintă un grup de afecțiuni idiopatice caracterizate prin dezvoltarea inflamației la nivelul tubului digestiv. Având incidența și prevalența în creștere, se estimează că afectează până la 0,2% din populația Europei. Deși etiologia nu este complet elucidată, în apariția acestei patologii sunt incriminate răspunsul imun inadecvat și modificările la nivelul microbiotei, induse de factori de mediu și genetici. Evoluția este îndelungată, iar una dintre cele mai grave complicații pe termen lung este apariția afecțiunilor maligne, riscul dezvoltării cancerului colorectal fiind de 2-3 ori mai mare decât la populația generală (4).
Prezentarea cazului
Pacient în vârstă de 32 de ani, cunoscut cu boală Crohn cu istoric de afectare pancolonică severă, s-a prezentat în iulie 2018 pentru reevaluare colonoscopică. Pacientul era nefumător, neconsumator de alcool, fără antecedente heredocolaterale neoplazice. A fost diagnosticat cu BII în 2007, la vârsta de 21 ani, în primii 2 ani având evoluție favorabilă sub tratament cu 5-aminosalicilați per os. Ulterior, a prezentat două pusee severe de activitate ce au necesitat cure de corticoterapie și introducerea în mai 2009 a tratamentului imunomodulator cu Azatioprină 2,5 mg/kgc pentru menținerea remisiunii. În iunie 2010, apariția unui nou puseu a impus inițierea tratamentului biologic cu Infliximab. Evoluția a fost inițial favorabilă, cu inducerea remisiunii clinice, însă în ianuarie 2011, după a 6-a administrare de Infliximab în doză standard (5 mg/kgc la 8 săptămâni), pacientul a prezentat reactivarea afecțiunii și a necesitat optimizarea tratamentului biologic până în aprilie 2012 (10 mg/kgc la 8 săptămâni).
La acel moment, fiind în remisiune clinică și endoscopică, s-a decis continuarea tratamentului în dozele standard.
În iunie 2013, pacientul a dezvoltat din nou simptome digestive, la evaluarea colonoscopică fiind identificate leziuni inflamatorii pancolonic, iar biologic – nivel seric de Infliximab suboptimal (4.6 mcg/ml) și anticorpi anti-Infliximab absenți, motiv pentru care s-a optimizat doza (10 mg/kgc la 8 săptămâni), în intervalul decembrie 2013 – iulie 2014, fiind necesară doza maximă de Infliximab pentru menținerea remisiunii (10 mg/kgc la 4 săptămâni). Ulterior, dat fiind evoluția favorabilă, a revenit la doza standard, însă simptomele au reapărut iar colonoscopic s-au decelat leziuni inflamatorii. Pacientul a refuzat creșterea dozelor de tratament biologic. În iulie 2015, revine cu puseu sever de boală, cu nivel de Infliximab suboptimal și anticorpi anti-Infliximab prezenți, motiv pentru care s-a reoptimizat tratamentul biologic (5mg/kgc la 4 săptămâni). Reevaluările endoscopice ulterioare nu au decelat leziuni active. La controlul colonoscopic din ianuarie 2018 nu s-au vizualizat leziuni inflamatorii active, cu excepția unei ulcerații cu diametrul de 10 mm, situată la 25 cm de orificiul anal, din care s-au prelevat multiple biopsii, ce au relevat mucoasă colonică cu aspect hiperplastic-regenerativ și minimă inflamație acută focală, nespecifică.
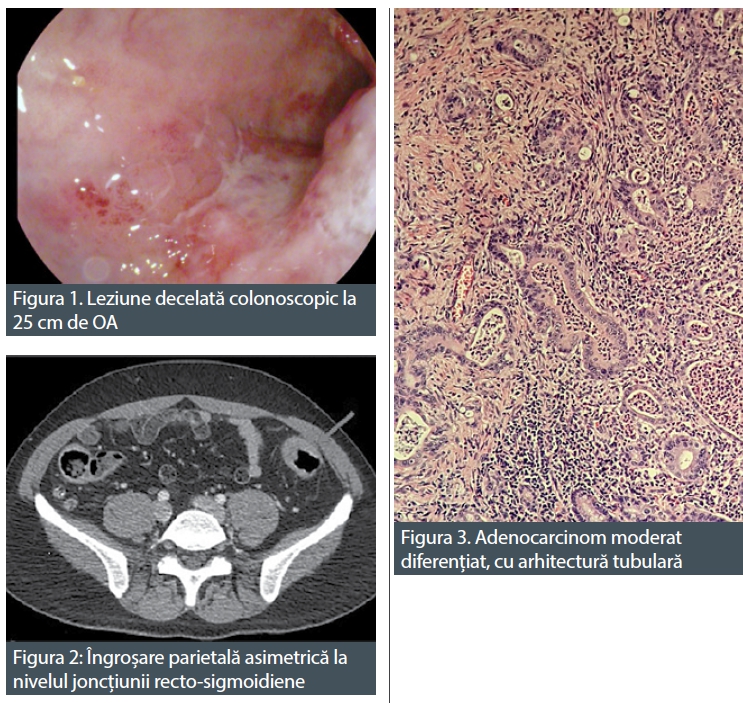
În iulie 2018, pacientul a revenit la control, normoponderal (IMC 20,6 kg/m2), fiind în remisiune clinică, iar biologic în limite normale. S-a efectuat o reevaluare colonoscopică la care s-au identificat pseudopolipi și leziuni cicatriceale postinflamatorii la nivelul întregului colon, iar la 25 cm de orificiul anal, un ulcer cu diametrul de 20 mm (Figura 1), din care s-au prelevat multiple biopsii. Aspectul histologic a relevat adenocarcinom colonic moderat diferențiat. La examinarea CT toraco-abdomino-pelvin, s-au vizualizat micronoduli pulmonari nespecifici, o îngroșare parietală la nivelul ceco-ascendentului cu aspect inflamator și o îngroșare parietală asimetrică la nivelul joncțiunii recto-sigmoidiene, sugestivă pentru un substrat tumoral (Figura 2).
S-a intervenit chirurgical, efectuându-se colectomie totală cu ileo-recto anastomoză termino-terminală, cu evoluție postoperatorie favorabilă. Rezultatul histopatologic al piesei de rezecție a fost de adenocarcinom colonic moderat diferențiat G2, cu arii de diferențiere mucinoasă și invazie perineurală asociată, pT3 pN1a PnI+ LVI+ (Figura 3). În octombrie 2018, s-a inițiat chimioterapia adjuvantă, efectuându-se 8 cicluri CAPOX, în asociere cu Filgrastim, încheierea acesteia fiind marcată de apariția reacțiilor adverse neurologice – parestezii distale la nivelul membrelor. Pacientul a continuat monitorizarea oncologică, la examinările imagistice ulterioare nefiind decelate semne de recidivă oncologică sau determinări secundare.
Discuții
EOCRC reprezintă 10% din cazurile diagnosticate de CCR, în absența altor afecțiuni cu risc crescut pentru CCR, așa cum sunt BII cu evoluție îndelungată. Aceste cancere sunt de multe ori depistate într-un stadiu avansat, iar ca localizare se dezvoltă mai frecvent la nivelul colonului stâng. Prognosticul este mai rezervat, deseori fiind tumori agresive, slab diferențiate sau cu celule „în inel cu pecete”. Dintre factorii de risc incriminați, doar o treime sunt reprezentați de factorii genetici. Dieta occidentală, consumul abuziv de alcool, obezitatea, fumatul, hiperlipidemia, diabetul zaharat, sedentarismul au fost identificați ca factori de risc modificabili asociați cu creșterea riscului de dezvoltare a EOCRC (3). În acest context, ultimul ghid pentru screeningul cancerului colorectal publicat în 2021 de Colegiul American de Gastroenterologie, sugerează începerea investigațiilor la populația cu risc mediu începând de la vârsta de 45 de ani.
Pacienții diagnosticați cu BII prezintă un risc crescut de a dezvolta neoplazii, atât intestinale, cât și extradigestive, acesta fiind atribuit fie inflamației cronice îndelungate, fie terapiilor imunosupresoare. Dezvoltarea CCR are ca mecanism cascada inflamație-displazie-carcinom, întâlnită și în alte tipuri de cancer (5).
Carcinogeneza este indusă prin mecanismele moleculare care contribuie și la apariția CCR sporadic, precum instabilitatea cromozomială, instabilitatea microsatelitară, mutațiile genelor KRAS, APC, p53, SMAD4, PIK3CA etc. însă, în cazul BII, procesul este modulat de mecanismele inflamatorii.
CCR sporadic se dezvoltă lent din leziuni polipoide displazice, care pot fi ușor decelate endoscopic. Însă, în cazul neoplaziilor din BII, evoluția este rapidă, putând fi multifocală, recurentă, iar leziunile sunt frecvent plate, dificil de identificat și de rezecat complet colonoscopic. Riscul de malignitate crește cu durata bolii, cu extensia și severitatea inflamației. Pentru scăderea riscului de apariție a CCR în BII, se recomandă controlul inflamației la nivel digestiv, iar administrarea de 5-aminosalicilați s-a dovedit a avea rol benefic pentru chemoprevenția CCR în colita ulcerativă. (5,6).
Pentru pacienții cu afectare colonică, ghidul ECCO pentru diagnosticul BII publicat în 2019 recomandă începerea screeningului colonoscopic pentru CCR la 8 ani de la apariția simptomelor, intervalul de supraveghere fiind stabilit în funcție de riscul pe care îl prezintă pacienții. Astfel, pentru cei cu risc crescut, definit prin prezența leziunilor displazice, a stenozelor, a afectării extensive colonice cu inflamație acută severă sau prin asocierea colangitei sclerozante primitive, se recomandă reevaluarea colonoscopică la 1 an. Efectuarea colonoscopiei de screening este recomandată în perioada de remisiune, cu utilizarea metodelor endoscopice dedicate – cromoendoscopia cu prelevarea de biopsii țintite (7).
În concluzie, cazul prezentat exemplifică riscul dezvoltării neoplaziilor intestinale la pacienții cu BII, indiferent de vârstă, fără alți factori de risc cunoscuți, în contextul prezenței inflamației severe, greu responsive la tratament. Acest tip de CCR prezintă pattern agresiv, rapid progresiv, adesea fiind diagnosticat în stadii avansate.
Bibliografie:
- World Health Organization. Globocan Europe 2020 [cited 2022 September 1]. https://gco.iarc.fr/today/data/factsheets/populations/908-europe-fact-sheets.pdf
- World Health Organization. Globocan Romania 2020 [cited 2022 September 1]. https://gco.iarc.fr/today/data/factsheets/populations/642-romania-fact-sheets.pdf
- O’Sullivan DE, Sutherland RL, Town S, Chow K, Fan J, Forbes N, et al. Risk Factors for Early-Onset Colorectal Cancer: A Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol. 2022 Jun; 20(6):1229-1240.e5.
- Zhao M, Gönczi L, Lakatos PL, Burisch J. The Burden of Inflammatory Bowel Disease in Europe in 2020. J Crohn’s Colitis. 2021 Sep 25; 15(9):1573–87.
- Frigerio S, Lartey DA, D’Haens GR, Grootjans J. The Role of the Immune System in IBD-Associated Colorectal Cancer: From Pro to Anti-Tumorigenic Mechanisms. Int J Mol Sci. 2021 Nov 25; 22(23):12739.
- Shah SC, Itzkowitz SH. Colorectal Cancer in Inflammatory Bowel Disease: Mechanisms and Management. Gastroenterology. 2022 Mar; 162(3):715-730.e3.
- Maaser C, Sturm A, Vavricka SR, Kucharzik T, Fiorino G, Annese V, et al. ECCO-ESGAR Guideline for Diagnostic Assessment in IBD Part 1: Initial diagnosis, monitoring of known IBD, detection of complications. J Crohn’s Colitis. 2019 Feb 1; 13(2):144-164K.
 Prof. Univ. Dr. Cristian Gheorghe
Prof. Univ. Dr. Cristian Gheorghe