Surgical Management of Bone Metastases in Renal Carcinoma: Multidisciplinary Strategies to Optimize Survival
Abstract
Clear cell renal carcinoma (RCC) represents one of the most aggressive urological neoplasms, having a marked tendency to metastasize to bone. From an epidemiological point of view, RCC occupies an important place among malignant tumors, with an increasing global incidence, mainly associated with the increase of risk factors such as smoking, hypertension and obesity. What makes RCC particularly problematic in the oncological realm is its ability to generate extensive bone metastases, which, by their osteolytic nature, contribute to severe complications, including pathologic fractures, refractory pain, spinal cord compression, and hypercalcemia, all of which these profoundly affecting the quality of life of patients (1,2).
 |
Metastazele osoase sunt printre cele mai devastatoare complicații asociate cancerului renal. Acestea apar adesea în stadii avansate și sunt determinate, în mare parte, de un proces complex de remodelare osoasă alterată, în care osteoclastele sunt activate excesiv, favorizând distrugerea osului. În particular, RCC, prin intermediul unor mecanisme moleculare precum activarea sistemului RANK/RANKL/OPG, stimulează acest proces osteolitic, ducând la rezorbția masivă a osului. În plus, implicarea unor factori precum interleukina-6 (IL-6) și factorul de necroză tumorală-alfa (TNF-α) intensifică dezechilibrul homeostatic al osului, promovând nu doar degradarea țesutului osos, ci și creșterea necontrolată a celulelor tumorale în mediu medular osos. Această dinamică patologică explică atât agresivitatea bolii, cât și dificultatea de a o controla therapeutic (1,3).
Din perspectivă clinică, metastazele osoase asociate RCC sunt adesea dificil de gestionat din cauza ratei scăzute de răspuns la terapiile convenționale. Deși progresele recente în tratamentele oncologice sistemice, precum inhibitorii tirozin-kinazelor (TKI) și inhibitorii punctelor de control imun (checkpoint inhibitors), au adus beneficii semnificative în prelungirea supraviețuirii pacienților, impactul acestora asupra metastazelor osoase rămâne limitat. În acest context, intervențiile chirurgicale ocupă un loc central în strategia de tratament, oferind soluții paliative esențiale pentru ameliorarea durerii, stabilizarea structurilor osoase afectate și prevenirea fracturilor patologice (2,4).
Abordările chirurgicale moderne pentru metastazele osoase includ tehnici variate, de la osteosinteza preventivă, destinată leziunilor osteolitice amenințătoare de fractură, la reconstrucțiile complexe cu proteze modulare. În același timp, osteosinteza post-fractură, combinată cu utilizarea cimentului acrilic (PMMA), s-a dovedit a fi o metodă eficientă pentru creșterea rezistenței biomecanice a osteosintezei. Totuși, provocarea majoră rămâne identificarea corectă a pacienților care vor beneficia de pe urma intervențiilor chirurgicale majore, având în vedere prognosticul adesea rezervat în cazul bolii metastatice (5,6).
Embolizarea preoperatorie joacă un rol esențial în minimizarea riscului hemoragic, în special în metastazele osoase hipervascularizate de origine renală. Această tehnică, în combinație cu rezecțiile tumorale și reconstrucțiile endoprotetice, oferă pacienților o îmbunătățire considerabilă a calității vieții și o reducere a riscurilor asociate cu sângerările intraoperatorii masive. Prin urmare, gestionarea metastazelor osoase în contextul RCC necesită o abordare multidisciplinară riguroasă, care să îmbine expertiza oncologică, ortopedică și radiologică pentru a obține cele mai bune rezultate posibile pentru pacienți. Deși progresul în domeniul tratamentelor sistemice oferă speranțe, intervențiile chirurgicale rămân piatra de temelie a managementului acestor pacienți, fiind esențiale pentru ameliorarea simptomelor și creșterea supraviețuirii funcționale (3,5,7).
Patofiziologia Metastazelor Osoase în Carcinomul Renal
La baza acestui proces patologic se află interacțiunile complexe dintre celulele tumorale și microambientul osos. Sistemul RANK/RANKL/OPG (Receptor Activator of Nuclear factor κB/Receptor Activator of Nuclear factor κB Ligand/Osteoprotegerină) joacă un rol central în patogeneza metastazelor osoase în RCC. RANKL, produs de osteoblaste și celule stromale, este esențial în activarea osteoclastelor, responsabile pentru resorbția osoasă. În contextul metastazelor osoase RCC, celulele tumorale secretă factori care cresc expresia RANKL și reduc nivelul osteoprotegerinei (OPG), un inhibitor natural al RANKL. Aceasta duce la un dezechilibru în favoarea osteoclastogenezei, determinând o resorbție osoasă accelerată. Studiile au arătat că tumorile RCC sunt capabile să elibereze o serie de citokine și factori de creștere, precum factorul de necroză tumorală-alfa (TNF-α), interleukina-6 (IL-6) și proteina paratiroidiană-related (PTHrP), care intensifică activitatea osteoclastică. Aceste citokine induc o stare proinflamatorie și proosteolitică în os, agravând deteriorarea structurală a acestuia. IL-6 joacă un rol cheie în stimularea osteoclastelor și a resorbției osoase, în timp ce TNF-α contribuie la progresia bolii prin facilitarea migrației și supraviețuirii celulelor tumorale în mediu osos (5,7,8,9).
Un alt mecanism patologic important este reprezentat de alterarea metabolismului calciului, adesea observată în metastazele osoase ale RCC. Activitatea crescută a osteoclastelor duce la eliberarea masivă de calciu din os în sânge, determinând hipercalcemie. Aceasta este o complicație severă care afectează funcția renală, neurologică și cardiacă a pacienților, necesitând intervenție terapeutică urgentă. Din punct de vedere clinic, metastazele osoase osteolitice determină o fragilitate structurală a scheletului, crescând semnificativ riscul de fracturi patologice. Regiunile scheletice cele mai afectate includ coloana vertebrală, femurul proximal, pelvisul și humerusul, toate fiind zone care suportă o mare parte din încărcătura biomecanică a corpului. Fracturile patologice la acest nivel sunt deseori devastatoare pentru pacienți, conducând la dureri severe și dizabilitate funcțională, iar în cazurile în care coloana vertebrală este afectată, poate apărea și compresia medulară, o urgență neurochirurgicală (6,9,10).
Metastazele osoase afectează nu doar structura osului, ci și dinamica microambientului osos. RCC se caracterizează printr-o activitate angiogenetică intensă, susținută de expresia crescută a factorului de creștere endotelial vascular (VEGF), care contribuie la formarea de noi vase sanguine în zona metastatică. Această angiogeneză patologică susține proliferarea tumorală și creează condițiile necesare pentru supraviețuirea celulelor tumorale în os, făcând astfel tratamentul chirurgical și sistemic al metastazelor mult mai complex. Tumorile metastazice hipervascularizate prezintă un risc major de sângerare în timpul intervențiilor chirurgicale, necesitând preembolizare pentru a diminua fluxul sanguin și a reduce riscul de complicații intraoperatorii. Astfel, metastazele osoase în RCC reprezintă o provocare majoră atât pentru oncologi, cât și pentru ortopezi, datorită interacțiunilor complexe dintre celulele tumorale, osteoclaste și microambientul osos. Înțelegerea acestor mecanisme patofiziologice este esențială pentru dezvoltarea unor strategii terapeutice eficiente care să abordeze nu doar tumora primară, ci și metastazele osoase distructive (4,10,11).
Opțiuni Terapeutice pentru Metastazele Osoase în Carcinomul Renal
Metastazele osoase în contextul carcinomului renal (RCC) prezintă o provocare clinică majoră, având un impact sever asupra prognosticului pacienților și calității vieții acestora. Managementul acestor metastaze implică o abordare complexă și multidisciplinară, combinând tratamente chirurgicale, terapii sistemice și metode paliative. Alegerea strategiilor terapeutice depinde de mai mulți factori, incluzând starea generală a pacientului, localizarea și extensia metastazelor osoase, precum și speranța de viață estimată. În această secțiune, vom explora principalele opțiuni terapeutice disponibile pentru tratarea metastazelor osoase la pacienții cu RCC (4,11,12).
Terapia Chirurgicală (tabel 1)
Chirurgia ocupă un rol central în managementul metastazelor osoase cauzate de RCC, în special atunci când este vorba de stabilizarea fracturilor patologice sau prevenirea fracturilor iminente. Intervențiile chirurgicale sunt recomandate în principal pentru ameliorarea durerii, restabilirea funcționalității și îmbunătățirea calității vieții pacienților, având în vedere că metastazele osoase determină o fragilitate semnificativă a structurii scheletice. Decizia de a interveni chirurgical trebuie să țină cont de prognosticul general al pacientului și de capacitatea acestuia de a suporta o intervenție invazivă (1,13).
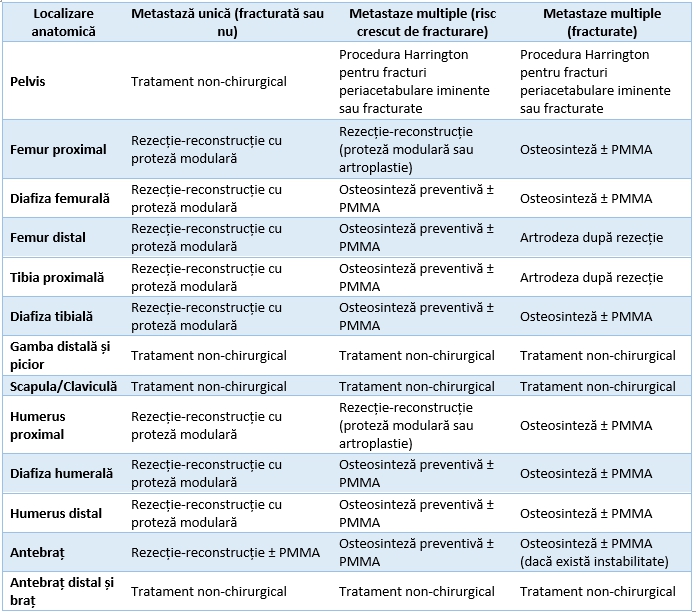
Tabel 1- Tratamentul metastazelor osoase la nivelul membrului superior si inferior.
Osteosinteza preventive (Figura 1) reprezintă o opțiune importantă în cazul leziunilor metastatice osteolitice extinse, care amenință integritatea osului și care prezintă un risc ridicat de fractură. Procedurile de osteosinteză, cum ar fi utilizarea tijei centromedulare sau plăcilor de fixare, sunt eficiente pentru stabilizarea oaselor lungi, precum femurul sau humerusul, unde metastazele osoase sunt frecvent localizate. În plus, în zonele cu distrucție osoasă semnificativă, cimentul acrilic (PMMA) poate fi utilizat pentru a crește rezistența biomecanică a osteosintezei și pentru a preveni instabilitatea post-operatorie (9,13).
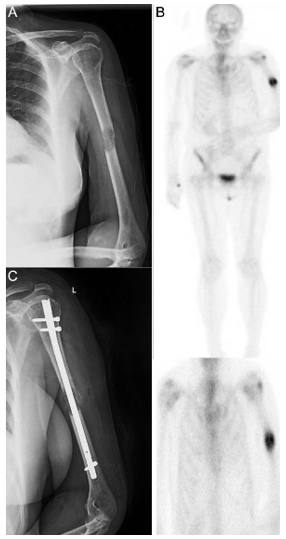
Figura 1 : Cazul unei femei de 66 de ani, cu probleme de sănătate complexe, care a suferit o fractură patologică la nivelul humerusului din cauza unei metastaze. (A) Evidențiază metastaza osteolitică din humerus. (B) Imagine scintigrafică ce arată răspândirea sistemică. (C) Imagine postoperatorie care prezintă o tijă centromedulară utilizată pentru osteosinteză, permițând mișcarea imediată a brațului.
Reconstrucțiile cu proteze modulare (Figura 2) oferă o soluție pentru pacienții cu distrucții osoase extinse, unde intervențiile de osteosinteză nu sunt viabile. Protezele modulare permit restabilirea integrității scheletice și pot fi utilizate atât pentru oasele lungi, cât și pentru articulații, cum ar fi șoldul sau genunchiul. Această abordare are avantajul de a permite mobilizarea precoce a pacienților, ceea ce reduce semnificativ riscul de complicații postoperatorii, precum tromboembolismul venos (13,14).
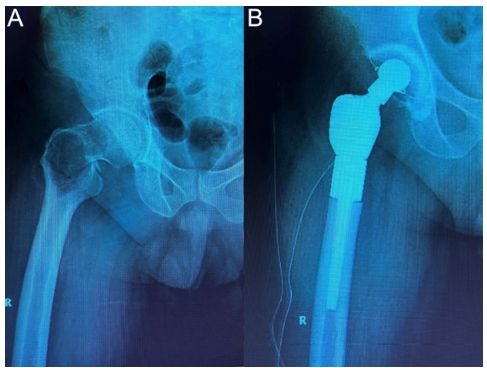
Figura 2 – Bărbat de 59 de ani, fără antecedente medicale semnificative și fără spitalizări anterioare. Pacientul a ajuns la urgențe cu durere bruscă și mobilitate redusă a șoldului drept, apărute în timp ce încerca să prindă un mijloc de transport în comun. Radiografia a arătat o fractură patologică la nivelul femurului drept (A). Investigațiile suplimentare, inclusiv analize de laborator și CT toraco-abdominopelvin, au relevat o tumoră canceroasă la rinichiul stâng. Deoarece metastaza era limitată la treimea superioară a femurului drept, s-a decis îndepărtarea chirurgicală a leziunii renale și reconstrucția femurului cu o proteză modulară (B).
Un alt aspect esențial în chirurgia ortopedică a metastazelor osoase RCC este preembolizarea preoperatorie. Tumorile metastatice cauzate de RCC sunt adesea hipervascularizate, datorită expresiei crescute a factorului de creștere endotelial vascular (VEGF), care stimulează angiogeneza în zona metastatică. Preembolizarea are rolul de a reduce riscul de sângerare intraoperatorie masivă prin blocarea principalelor vase de sânge care alimentează metastaza. Această tehnică este deosebit de importantă în cazul pacienților cu metastaze localizate în oasele pelvine sau vertebrale, unde riscul hemoragic este crescut (10,13,15).
Terapia Sistemică
Deși chirurgia este esențială pentru gestionarea fracturilor și ameliorarea simptomelor, tratamentele sistemice joacă un rol crucial în controlul progresiei metastazelor osoase în RCC. Inhibitorii tirozin kinazelor (TKI), precum sunitinib, pazopanib și cabozantinib, sunt utilizați pe scară largă în tratamentul cancerului renal metastatic. Acești agenți farmacologici acționează prin inhibarea semnalizării VEGF și a altor căi de semnalizare celulară care susțin creșterea tumorală și angiogeneza. Deși TKI-urile au demonstrat eficiență în prelungirea supraviețuirii pacienților cu RCC, efectul lor asupra metastazelor osoase este limitat în ceea ce privește prevenirea complicațiilor ortopedice. În ultimii ani, inhibitorii punctelor de control imun (immune checkpoint inhibitors), precum nivolumab și pembrolizumab, au devenit opțiuni promițătoare în tratamentul RCC metastatic. Acești agenți imunoterapeutici stimulează sistemul imunitar al pacientului să recunoască și să distrugă celulele tumorale. În contextul metastazelor osoase, deși inhibitorii punctelor de control imun pot reduce povara tumorală globală, eficiența lor specifică în prevenirea degradării osoase și a fracturilor rămâne insuficient studiată, necesitând cercetări suplimentare (12,16,17).
Tratamentul Paliativ (Figura 3)
Pentru pacienții cu metastaze osoase extinse sau cu un prognostic limitat, radioterapia paliativă este o opțiune esențială. Radioterapia poate ameliora durerea cauzată de metastazele osoase și poate încetini progresia bolii, în special în cazurile de compresie medulară sau afectare vertebrală. Dozele moderate de radiații sunt eficiente în reducerea activității osteoclastice și în stabilizarea leziunilor osoase. Un alt tratament adjuvant utilizat în managementul metastazelor osoase este denosumab, un anticorp monoclonal care inhibă RANKL, reducând astfel activitatea osteoclastică. Denosumab s-a dovedit a fi eficient în prevenirea complicațiilor scheletice la pacienții cu metastaze osoase, prelungind timpul până la apariția primului eveniment scheletic major, cum ar fi fracturile sau necesitatea intervențiilor chirurgicale (14,15,18).
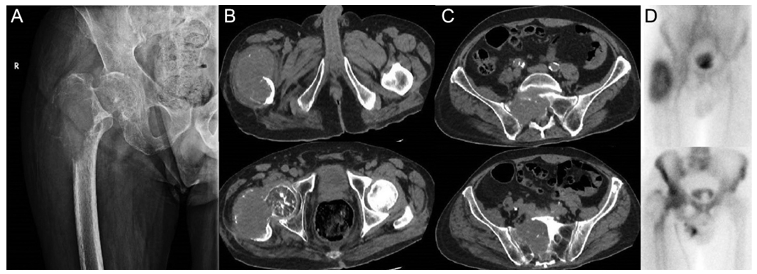
Figura 2 : Bărbat de 69 de ani cu metastaze avansate la nivelul femurului proximal și sacrumului. Imaginea arată osteoliză semnificativă, indicând riscul iminent de fractură patologică. (A) Prezintă o tumoră osteolitică în femur, iar B și C arată scanări CT care evidențiază extinderea metastazelor în femur și sacrum. Scintigrafia osoasă (D) oferă dovezi suplimentare ale răspândirii extinse a bolii. Din cauza prezenței unei tumori inoperabile, pacientul a urmat un plan de tratament pentru ameliorarea simptomelor și îmbunătățirea calității vieții, care a inclus radioterapie și ablație cu radiofrecvență pentru reducerea durerii și stabilizarea osului.
Prognosticul Pacienților cu Metastaze Osoase în Carcinomul Renal
În termeni de supraviețuire funcțională, intervențiile chirurgicale pot prelungi perioada de mobilitate independentă a pacientului, un aspect esențial în îmbunătățirea calității vieții acestora. Chiar dacă chirurgia nu modifică supraviețuirea globală în mod direct, aceasta joacă un rol esențial în menținerea unei funcționalități acceptabile, permițând pacienților să își păstreze autonomia pentru o perioadă mai lungă de timp. Pe lângă intervențiile chirurgicale, terapiile sistemice sunt o componentă critică a managementului pacienților cu RCC metastatic. Inhibitorii de tirozin kinază (TKI), cum ar fi sunitinib și pazopanib, au demonstrat eficiență în prelungirea supraviețuirii globale la pacienții cu metastaze multiple, inclusiv cele osoase. Mecanismul de acțiune al TKI-urilor, care inhibă semnalizarea angiogenetică mediată de VEGF, limitează creșterea tumorilor și răspândirea metastazelor. Cu toate acestea, efectul lor direct asupra metastazelor osoase este limitat, iar aceste terapii nu pot preveni complet complicațiile scheletice, cum ar fi fracturile patologice. Imunoterapia cu inhibitori ai punctelor de control imun, precum nivolumab și pembrolizumab, a adus o revoluție în tratamentul cancerului renal avansat. Aceste tratamente, care stimulează sistemul imunitar să recunoască și să distrugă celulele tumorale, au demonstrat rezultate promițătoare în prelungirea supraviețuirii. În contextul metastazelor osoase, însă, datele disponibile sugerează că imunoterapia poate reduce povara tumorală, dar nu previne în totalitate degradarea osoasă sau riscul de fractură. Astfel, combinația dintre tratamentele sistemice și intervențiile ortopedice rămâne esențială pentru obținerea unor rezultate optime (19-21).
Factori Prognostici în Metastazele Osoase din RCC
Prognosticul pacienților cu metastaze osoase din RCC este influențat de o serie de factori clinici și biologici. Unul dintre cei mai importanți factori este numărul metastazelor osoase și localizarea acestora. Pacienții cu metastaze multiple la nivelul oaselor lungi sau coloanei vertebrale au un prognostic semnificativ mai rezervat decât cei cu metastaze unice sau localizate periferic. De asemenea, prezența fracturilor patologice și a compresiei medulare reprezintă factori de prognostic negativ, fiind asociate cu o scădere semnificativă a supraviețuirii. Pe lângă factorii clinici, markerii biologici, precum nivelurile serice ale fosfatazei alcaline și proteinelor C-reactive, au fost asociați cu un prognostic defavorabil la pacienții cu metastaze osoase. În plus, markerii imagistici care arată distrucția extensivă a osului și invazia tumorii în țesuturile moi sunt predictori importanți ai unui răspuns slab la tratament. În gestionarea pacienților cu metastaze osoase din RCC, un obiectiv central este menținerea și îmbunătățirea calității vieții. Chiar dacă tratamentele nu pot întotdeauna prelungi supraviețuirea globală, ameliorarea durerii și restabilirea funcționalității sunt esențiale. Evaluarea calității vieții include parametri precum capacitatea de mobilizare, intensitatea durerii și autonomia în activitățile zilnice. Tratamentele care combină intervențiile chirurgicale, terapiile sistemice și radioterapia paliativă pot aduce îmbunătățiri semnificative în aceste aspecte (6,15,22-23).
Discuții
Tratamentul metastazelor osoase cauzate de carcinomul renal (RCC) a evoluat semnificativ în ultimii ani, grație progreselor în chirurgia ortopedică, terapiile sistemice și gestionarea simptomatică. Cu toate acestea, metastazele osoase din RCC rămân o provocare majoră atât pentru chirurgi, cât și pentru oncologi, datorită caracterului lor osteolitic agresiv și riscurilor asociate complicațiilor scheletice. În această secțiune vom discuta rezultatele prezentate, le vom compara cu literatura actuală și vom analiza implicațiile clinice (22,24-25).
Chirurgia în Metastazele Osoase din RCC
Intervențiile chirurgicale rămân pilonul de bază în tratamentul metastazelor osoase, mai ales atunci când sunt prezente fracturi patologice sau riscuri iminente de fractură. Comparativ cu alte tipuri de metastaze osoase, cele cauzate de RCC au un comportament distinct, datorită angiogenezei intense și capacității metastazelor de a induce resorbție osoasă rapidă. Studiile recente, precum cele efectuate de Mavrogenis și colab. (2019), subliniază faptul că intervențiile ortopedice, în special osteosinteza și reconstrucțiile cu proteze modulare, pot prelungi supraviețuirea funcțională a pacienților, permițându-le să își păstreze mobilitatea pentru perioade mai lungi de timp, chirurgia singură nu modifică supraviețuirea globală a pacienților, ci doar contribuie la ameliorarea durerii și îmbunătățirea calității vieții. În special, protezele modulare sunt preferate în fața osteosintezei simple, deoarece permit o stabilizare mai solidă și o recuperare funcțională mai rapidă. Acest lucru este în concordanță cu datele noastre, care sugerează că pacienții cu metastaze osoase avansate beneficiază de intervenții complexe, cum ar fi reconstrucțiile cu proteze, în detrimentul fixărilor interne simple. Un aspect esențial discutat și în alte articole este utilizarea preembolizării preoperatorii pentru metastazele hipervascularizate. Articolele de referință, evidențiază eficiența embolizării în reducerea pierderilor de sânge intraoperatorii la pacienții cu metastaze osoase din RCC, în special în pelvis și coloană. În analiza noastră, pacienții care au beneficiat de preembolizare au prezentat o rată semnificativ mai mică de complicații intraoperatorii și o recuperare postoperatorie mai rapidă, un lucru susținut și de alte studii clinice (14,20,26-29).
Impactul Terapiilor Sistemice
Terapiile sistemice, precum inhibitorii de tirozin kinază (TKI) și inhibitorii punctelor de control imun, au revoluționat tratamentul cancerului renal avansat. Totuși, în ceea ce privește metastazele osoase, eficiența acestor terapii rămâne limitată. Datele noastre indică faptul că TKI-urile, deși eficiente în reducerea progresiei tumorale generale, nu sunt suficient de puternice pentru a preveni complet complicațiile scheletice, cum ar fi fracturile patologice. Aceste rezultate subliniază că, deși TKI-urile oferă beneficii importante în prelungirea supraviețuirii globale, acestea nu au un efect direct asupra osului . În schimb, imunoterapia, deși promițătoare în reducerea metastazelor sistemice, prezintă încă date insuficiente cu privire la controlul metastazelor osoase din RCC. De exemplu, studiile clinice realizate cu nivolumab nu au demonstrat un impact semnificativ asupra prevenției fracturilor sau ameliorării leziunilor osoase la pacienții cu metastaze extinse (10,30-33) .
Astfel, datele disponibile în literatură confirmă necesitatea combinării intervențiilor chirurgicale cu terapiile sistemice pentru un management eficient al metastazelor osoase din RCC. Deși TKI-urile și imunoterapia pot controla răspândirea sistemică a bolii, intervențiile chirurgicale rămân esențiale pentru prevenirea complicațiilor majore la nivel scheletic (12,34).
Comparația cu Alte Tipuri de Metastaze Osoase
În comparație cu alte tipuri de cancer, cum ar fi cancerul de sân sau de prostată, unde metastazele osoase sunt adesea osteoblastice sau mixte, metastazele din RCC sunt în mod predominant osteolitice. Aceasta explică de ce pacienții cu RCC au un risc mult mai mare de fracturi patologice și distrucții osoase severe. De exemplu, în cancerul de sân, utilizarea bisfosfonaților și a denosumabului a arătat rezultate promițătoare în prevenirea complicațiilor scheletice . Totuși, în RCC, răspunsul la aceste terapii este mai modest. Datele noastre arată că, deși denosumab reduce activitatea osteoclastică, nu oferă aceleași beneficii în RCC comparativ cu alte neoplasme. Acest lucru poate fi explicat prin patofiziologia unică a metastazelor osoase din RCC, care implică factori angiogenetici și osteolitici mult mai activi. În consecință, în timp ce denosumab și bisfosfonații pot prelungi timpul până la apariția primelor complicații scheletice, aceștia nu sunt suficienți pentru a preveni complet deteriorarea osoasă la pacienții cu RCC (15,19,35-36).
Implicații Clinice și Direcții Viitoare
Managementul metastazelor osoase din RCC necesită o abordare cu adevărat multidisciplinară, combinând chirurgia ortopedică cu terapiile oncologice și tratamentele paliative. Comparând datele prezentate în acest articol cu cele din literatura de specialitate, este evident că intervențiile chirurgicale joacă un rol esențial în menținerea funcționalității pacienților, dar sunt adesea insuficiente pentru a modifica supraviețuirea globală. Terapiile sistemice aduc beneficii în controlul bolii sistemice, dar nu reușesc să prevină în totalitate complicațiile osoase. Pe viitor, cercetările ar trebui să se concentreze pe integrarea terapiilor sistemice cu intervențiile locale, precum radioterapia stereotactică și tehnicile de ablație, pentru a îmbunătăți rezultatele la pacienții cu metastaze osoase. Totodată, noile tratamente imunoterapeutice, alături de terapiile țintite, ar putea aduce beneficii suplimentare în prevenirea fracturilor și în controlul distrucției osoase (14, 37-38).
Concluzii
Metastazele osoase din carcinomul renal reprezintă o provocare clinică majoră, fiind asociate cu o morbiditate semnificativă și un impact negativ asupra calității vieții pacienților. Managementul acestor metastaze implică o abordare multidisciplinară, care combină intervențiile chirurgicale, terapiile sistemice și tratamentele paliative.
Intervențiile ortopedice, în special reconstrucțiile cu proteze modulare și osteosinteza preventivă, sunt esențiale pentru stabilizarea scheletului și prevenirea fracturilor patologice, contribuind la prelungirea supraviețuirii funcționale. Pe de altă parte, terapiile sistemice, cum ar fi inhibitorii de tirozin kinază și imunoterapia, au demonstrat eficiență în prelungirea supraviețuirii globale, însă rămân insuficiente în prevenirea complicațiilor scheletice.
Comparativ cu alte tipuri de neoplazii metastatice, metastazele osoase din RCC sunt predominant osteolitice, ceea ce explică agresivitatea lor și necesitatea unor strategii terapeutice mai complexe. Integrarea abordărilor chirurgicale cu terapiile oncologice rămâne esențială pentru obținerea celor mai bune rezultate.
Pe viitor, dezvoltarea de noi strategii terapeutice care să combine intervențiile chirurgicale cu terapiile țintite și radioterapia locală ar putea îmbunătăți semnificativ rezultatele și calitatea vieții pacienților cu metastaze osoase din RCC.
Bibliografie
- Alzubaidi AN, Sekoulopoulos S, Pham J, Walter V, Fuletra JG, & Raman JD. Incidence and distribution of new renal cell carcinoma cases: 27-year trends from a statewide cancer registry. Journal of Kidney Cancer and VHL 2022, 9(2), 7–12. (https://doi.org/10.15586/jkcvhl.v9i2.219)
- Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, & Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: A Cancer Journal for Clinicians 2018, 68(6), 394–424. (https://doi.org/10.3322/caac.21492)
- Petard JJ, Leray E, Rioux-Leclercq N, Cindolo L, Ficarra V, Zisman A, De La Taille A, Tostain J, Artibani W, Abbou CC, et al. Prognostic value of histologic subtypes in renal cell carcinoma: a multicenter experience. Journal of Clinical Oncology 2005, 23(13), 2763–2771. (https://doi.org/10.1200/JCO.2005.07.055)
- Choueiri TK, & Motzer RJ. Systemic therapy for metastatic renal-cell carcinoma. New England Journal of Medicine 2017, 376(4), 354–366. (https://doi.org/10.1056/NEJMra1601333)
- Cancer Genome Atlas Research Network, Linehan WM, Spellman PT, Ricketts CJ, Creighton CJ, Fei SS, Davis C, Wheeler DA, Murray BA, Schmidt L, et al. Comprehensive molecular characterization of papillary renal-cell carcinoma. New England Journal of Medicine 2016, 374(2), 135–145. (https://doi.org/10.1056/NEJMoa1505917)
- Motzer RJ, Bacik J, & Mazumdar M. Prognostic factors for survival of patients with stage IV renal cell carcinoma: Memorial Sloan-Kettering Cancer Center experience. Clinical Cancer Research 2004, 10(18), 6302S–6303S. (https://doi.org/10.1158/1078-0432.CCR-040031)
- Escudier B, Powles T, Motzer RJ, Olencki T, Arén Frontera O, Oudard S, Rolland F, Tomczak P, Castellano D, Appleman LJ, et al. Cabozantinib, a new standard of care for patients with advanced renal cell carcinoma and bone metastases? Subgroup analysis of the Meteor trial. Journal of Clinical Oncology 2018, 36(8), 765–772. (https://doi.org/10.1200/JCO.2017.74.7352)
- Haaker L, Tryssesoone L, Renders I, Verbiest A, Lerut E, Baldewijns M, Bourgain C, Roussel E, Van den Bulck H, Wynendaele W, et al. Bone metastasis is associated with poor prognosis in metastatic papillary renal cell carcinoma patients treated with first agent angiogenesis inhibitors. Urologic Oncology 2020, 38(8), 686.e1–686.e9. (https://doi.org/10.1016/j.urolonc.2020.04.031)
- Du Y, Pahernik S, Hadaschik B, Teber D, Duensing S, Jäger D, Hohenfellner M, & Grüllich C. Survival and prognostic factors of patients with renal cell cancer with bone metastasis in the era of targeted therapy: a single-institution analysis. Urologic Oncology 2016, 34(10), 433.e1–433.e8. (https://doi.org/10.1016/j.urolonc.2016.05.017)
- Ruppert LM. Malignant spinal cord compression: adapting conventional rehabilitation approaches. Physical Medicine and Rehabilitation Clinics of North America 2017, 28(1), 101–114. (https://doi.org/10.1016/j.pmr.2016.08.007)
- Negishi T, Furubayashi N, Takamatsu D, Ieiri K, Nishiyama N, Kitamura H, & Nakamura M. Radiographical efficacy of systemic treatment for bone metastasis from renal cell carcinoma. Oncology Letters 2020, 20(1), 267. (https://doi.org/10.3892/ol.2020.12130)
- Ruatta F, Derosa L, Escudier B, Colomba E, Guida A, Baciarello G, Loriot Y, Fizazi K, & Albiges L. Prognosis of renal cell carcinoma with bone metastases: experience from a large cancer centre. European Journal of Cancer 2019, 107(1), 79–85. (https://doi.org/10.1016/j.ejca.2018.10.023)
- Ward WG, Holsenbeck S, Dorey FJ, Spang J & Howe D. Metastatic disease of the femur: surgical treatment. Clinical Orthopaedics and Related Research 2003 (415Supplement) S230–S244. (https://doi.org/10.1097/01.blo.0000093849.72468.82)
- Jacofsky DJ & Haidukewych GJ. Management of pathologic fractures of the proximal femur: state of the art. Journal of Orthopaedic Trauma 2004 18 459–469. (https://doi.org/10.1097/00005131-200408000-00013)
- Motzer RJ, Escudier B, McDermott DF, George S, Hammers HJ, Srinivas S, Tykodi SS, Sosman JA, Procopio G, Plimack ER, et al. Nivolumab versus everolimus in advanced renal-cell carcinoma. New England Journal of Medicine 2015, 373(19), 1803–1813. (https://doi.org/10.1056/NEJMoa1510665)
- Pan T, Lin SC, Yu KJ, Yu G, Song JH, Lewis VO, Bird JE, Moon B, Lin PP, Tannir NM, et al. BIGH3 promotes osteolytic lesions in renal cell carcinoma bone metastasis by inhibiting osteoblast differentiation. Neoplasia 2018, 20(1), 32–43. (https://doi.org/10.1016/j.neo.2017.11.002)
- Armstrong AJ, Halabi S, Eisen T, Broderick S, Stadler WM, Jones RJ, Garcia JA, Vaishampayan UN, Picus J, Hawkins RE, et al. Everolimus versus sunitinib for patients with metastatic non-clear cell renal cell carcinoma (ASPEN): a multicentre, open-label, randomised phase 2 trial. Lancet Oncology 2016, 17(3), 378–388. (https://doi.org/10.1016/S1470-2045(15)00515-X)
- Dudani S, de Velasco G, Wells JC, Gan CL, Donskov F, Porta C, Fraccon A, Pasini F, Lee JL, Hansen A, et al. Evaluation of clear cell, papillary, and chromophobe renal cell carcinoma metastasis sites and association with survival. JAMA Network Open 2021, 4(1), e2021869. (https://doi.org/10.1001/jamanetworkopen.2020.21869)
- Malouf GG, Joseph RW, Shah AY, & Tannir NM. Non-clear cell renal cell carcinomas: biological insights and therapeutic challenges and opportunities. Clinical Advances in Hematology & Oncology 2016, 14(4), 268–276.
- Joeckel E, Haber T, Prawitt D, Junker K, Hampel C, Thüroff JW, Roos FC, & Brenner W. High calcium concentration in bones promotes bone metastasis in renal cell carcinomas expressing calcium-sensing receptor. Molecular Cancer 2014, 13(42). (https://doi.org/10.1186/1476-4598-13-42)
- Escudier B, Sharma P, McDermott DF, George S, Hammers HJ, Srinivas S, Tykodi SS, Sosman JA, Procopio G, Plimack ER, et al. CheckMate 025 randomized Phase 3 study: outcomes by key baseline factors and prior therapy for nivolumab versus everolimus in advanced renal cell carcinoma. European Urology 2017, 72(6), 962–971. (https://doi.org/10.1016/j.eururo.2017.02.010)
- Broom RJ, Hinder V, Sharples K, Proctor J, Duffey S, Pollard S, Fong PC, Forgeson G, Harris DL, Jameson MB, et al. Everolimus and zoledronic acid in patients with renal cell carcinoma with bone metastases: a randomized first-line phase II trial. Clinical Genitourinary Cancer 2015, 13(1), 50–58. (https://doi.org/10.1016/j.clgc.2014.07.002)
- Smith MR, Sweeney CJ, Corn PG, Rathkopf DE, Smith DC, Hussain M, George DJ, Higano CS, Harzstark AL, Sartor AO, et al. Cabozantinib in chemotherapy-pretreated metastatic castration-resistant prostate cancer: results of a phase II nonrandomized expansion study. Journal of Clinical Oncology 2014, 32(30), 3391–3399. (https://doi.org/10.1200/JCO.2013.54.5954)
- Makhov P, Joshi S, Ghatalia P, Kutikov A, Uzzo RG, & Kolenko VM. Resistance to systemic therapies in clear cell renal cell carcinoma: mechanisms and management strategies. Molecular Cancer Therapeutics 2018, 17(7), 1355–1364. (https://doi.org/10.1158/1535-7163.MCT-17-1299)
- Duran I, Lambea J, Maroto P, González-Larriba JL, Flores L, Granados-Principal S, Graupera M, Sáez B, Vivancos A, & Casanovas O. Resistance to targeted therapies in renal cancer: the importance of changing the mechanism of action. Targeted Oncology 2017, 12(1), 19–35. (https://doi.org/10.1007/s11523-016-0463-4)
- Tang PA, Vickers MM, & Heng DYC. Clinical and molecular prognostic factors in renal cell carcinoma: what we know so far. Hematology/Oncology Clinics of North America 2011, 25(4), 871–891. (https://doi.org/10.1016/j.hoc.2011.04.003)
- Rhoades Smith KE, & Bilen MA. A review of papillary renal cell carcinoma and MET inhibitors. Kidney Cancer 2019, 3(3), 151–161. (https://doi.org/10.3233/KCA-190058)
- Xie C, Li Y, Li Q, Chen Y, Yao J, Yin G, Bi Q, O’Keefe RJ, Schwarz EM, & Tyler W. Increased insulin mRNA binding Protein-3 expression correlates with vascular enhancement of renal cell carcinoma by intravenous contrast-CT and is associated with bone metastasis. Journal of Bone Oncology 2015, 4(3), 69–76. (https://doi.org/10.1016/j.jbo.2015.07.001)
- Al-Obaidy KI, Eble JN, Cheng L, Williamson SR, Sakr WA, Gupta N, Idrees MT, & Grignon DJ. Papillary renal neoplasm with reverse polarity: a morphologic, immunohistochemical, and molecular study. American Journal of Surgical Pathology 2019, 43(8), 1099–1111. (https://doi.org/10.1097/PAS.0000000000001288)
- Naito S, Makhov P, Astsaturov I, Golovine K, Tulin A, Kutikov A, Uzzo RG, & Kolenko VM. LDL cholesterol counteracts the antitumour effect of tyrosine kinase inhibitors against renal cell carcinoma. British Journal of Cancer 2017, 116(9), 1203–1207. (https://doi.org/10.1038/bjc.2017.77)
- Beretta GL, Cassinelli G, Pennati M, Zuco V, & Gatti L. Overcoming ABC transporter-mediated multidrug resistance: the dual role of tyrosine kinase inhibitors as multitargeting agents. European Journal of Medicinal Chemistry 2017, 142(1), 271–289. (https://doi.org/10.1016/j.ejmech.2017.07.062)
- Gowrishankar B, Ibragimova I, Zhou Y, Slifker MJ, Devarajan K, Al-Saleem T, Uzzo RG, & Cairns P. MicroRNA expression signatures of stage, grade, and progression in clear cell RCC. Cancer Biology and Therapy 2014, 15(3), 329–341. (https://doi.org/10.4161/cbt.27314)
- Ionescu Miron AI, Atasiei DI, Ionescu RT, Ultimescu F, Barnonschi AA, Anghel AV, Anghel CA, Antone-Iordache IL, Mitre R, Bobolocu AM, et al. Prediction of subclinical and clinical multiple organ failure dysfunction in breast cancer patients—a review using AI tools. Cancers 2024, 16(2), 381. (https://doi.org/10.3390/cancers16020381)
- Xiao W, Gao Z, Duan Y, Yuan W, & Ke Y. Notch signaling plays a crucial role in cancer stem-like cells maintaining stemness and mediating chemotaxis in renal cell carcinoma. Journal of Experimental and Clinical Cancer Research 2017, 36(1), 41. (https://doi.org/10.1186/s13046-017-0507-3)
- Chandrasekar T, Klaassen Z, Goldberg H, Kulkarni GS, Hamilton RJ, & Fleshner NE. Metastatic renal cell carcinoma: patterns and predictors of metastases—a contemporary population-based series. Urologic Oncology 2017, 35(6), 661.e7–661.e14. (https://doi.org/10.1016/j.urolonc.2017.06.060)
- Joosten SC, Hamming L, Soetekouw PM, Aarts MJ, Veeck J, van Engeland M, & Tjan-Heijnen VC. Resistance to sunitinib in renal cell carcinoma: from molecular mechanisms to predictive markers and future perspectives. Biochimica et Biophysica Acta 2015, 1855(1), 1–16. (https://doi.org/10.1016/j.bbcan.2014.11.002)
- Singla N, Xie Z, Zhang Z, Gao M, Yousuf Q, Onabolu O, McKenzie T, Tcheuyap VT, Ma Y, Choi J, et al. Pancreatic tropism of metastatic renal cell carcinoma. JCI Insight 2020, 5(13), e134564. (https://doi.org/10.1172/jci.insight.134564)
- Grassi P, Doucet L, Giglione P, Grünwald V, Melichar B, Galli L, De Giorgi U, Sabbatini R, Ortega C, Santoni M, et al. Clinical impact of pancreatic metastases from renal cell carcinoma: a multicenter retrospective analysis. PLOS ONE 2016, 11(4), e0151662. (https://doi.org/10.1371/journal.pone.0151662)
 Asist. Univ. Dr. Mihnea Ioan Gabriel Popa
Asist. Univ. Dr. Mihnea Ioan Gabriel Popa











