ABSTRACT
Anevrismele aortei abdominale (AAA) reprezintă o condiție patologică, care prin evoluția lor amenință viața pacienților. În lipsa tratamentului adecvat, se consideră că aproximativ 30% dintre pacienții cu anevrisme de aortă abdominală (AAA), mor prin ruptura acestora, mai devreme sau mai târziu.
În a doua jumătate a secolului XX a fost pusă la punct tehnica chirurgicală de rezolvare a lor prin extirpare și interpoziția unei proteze vasculare care să restabilească continuitatea la nivelul aortei abdomiale.
Începând din ultimii ani ai secolului trecut și mai cu seamă după anul 2000 s-a dezvoltat tehnică de rezolvare endovasculară prin inserția în interiorul sacului anevrismal unui stentgraft bifurcat, folosind metodele radiologiei intervenționale.
Metoda inserției endovasculare a stentgrafturilor aortice în tratamentul anevrismelor aortice infrarenale (EVAR) a cunoscut o dezvoltare impetuoasă, datorită în primul rând, caracterului ei minimalinvaziv, ea putând fi realizată percutanat cu anestezie locală.
În prezent EVAR tinde să înlocuiască metoda chirurgicală deschisă, totuși anumite aspecte legate de evoluția pe termen lung al acestor pacienți rămân să fie elucidate.
Introducere
În general anevrismul arterial se definește ca o dilatație patologică a unei artere comparativ cu dimensiunea ei normală.
Anevrismul aortei abdominale presupune creșterea acestui diametru cu peste 50%. El este localizat în 80% din cazuri distal de emergența arterelor renale, motiv pentru care este denumit uzual, anevrism de aortă abdominală infrarenală.
În restul de 20% din cazuri sunt implicate și arterele renale sau arterele viscerale, când anevrismul se încadrează în categoria anevrismelor toracoabdominale.
Dimensiunea normală a aortei abdominale infrarenale este de 2.5 cm. O creștere a acestui diametru peste 3 cm definește în general anevrismul aortei abdominale (AAA). Peste 5.5 cm diametru, anevrismul este considerat cu risc de ruptură și trebuie avută în vedere rezolvarea lui(1).
Anevrismele aortei abdominale reprezintă în SUA, a 14 – cauza de mortalitate, producând aproximativ 6000 de decese pe an(2).
Incidența este 7.6 % pentru bărbați și 4.2% pentru femei în populația peste 65 de ani(3).
Dacă nu sunt tratate, se estimează că o treime din aceste anevrisme se rup în cele din urmă. Ruptura este de obicei fatală, cu o mortalitate de până la 90%.
Factorii de risc care se asociază cu AAA sunt numeroși. Vârsta: AAA se întâlnește mult mai frecvent după 65 de ani (4.5 -7.5%), sexul: AAA este mai frecvent (x6) la bărbați, este mai frecvent la fumători și hipertensivi și deasemeni mai frecvent la pacienții cu ateroscleroză(4).
În cursul primei jumătăți a secolului XX au fost încercate diferite proceduri de tratament chirurgical al acestor anevrisme, dar de abia în 1950, Charles Dubost realizează prima rezecție chirurgicală a unui anevrism de aortă abdominală și refacerea fluxului arterial la nivelul aortei prin inserția unei homogrefe de la cadavru(5).
Câțiva ani mai tarziu, Michael De Bakey introduce utilizarea protezelor vasculare sintetice (politereftelat de etilenglicol – dacron) în rezolvarea chirurgicală a anevrismelor aortice(6).
În România, prima rezolvare chirurgicală a unui anevrism de aortă abdominală este atribuită lui Florian Mandache, la Spitalul Brâncovenesc din București în 1962.
În ultimii 20 de ani, inserția endovasculară a unui stengraft (EVAR) a căpătat o largă răspândire, devenind cea mai comună metodă de tratament electiv al pacienților cu AAA.
Deasemeni este în curs de evaluare aplicarea EVAR în urgență la pacienții cu AAA rupte.
Avantajele EVAR comparativ cu operația chirurgicală sunt: eliminarea traumatismului chirurgical în sine (laparotomie, disecție retroperitoneală extinsă, sângerare, etc.) precum și abordul exclusiv percutanat prin puncția arterelor femurale și posibilitatea realizării procedurii cu anestezie locală.
Pacienții tratați prin EVAR nu necesită îngrijiri de terapie intensivă și pot fi externați din spital la 2 zile de la procedură.
Indicația de tratament
Indicațiile de tratament sunt comune atât pentru tratamentul chirurgical deschis cât și pentru cel intervențional prin EVAR.
Cel mai important parametru este diametrul, fiind unanim acceptat ca începând cu 5.5 cm este indicată rezolvarea lor. Dar și rata de creștere mai mare de 0.5 cm la 6 luni sau apariția simptomelor poate grăbi decizia de rezolvare intervenționala sau chirurgicală(7).
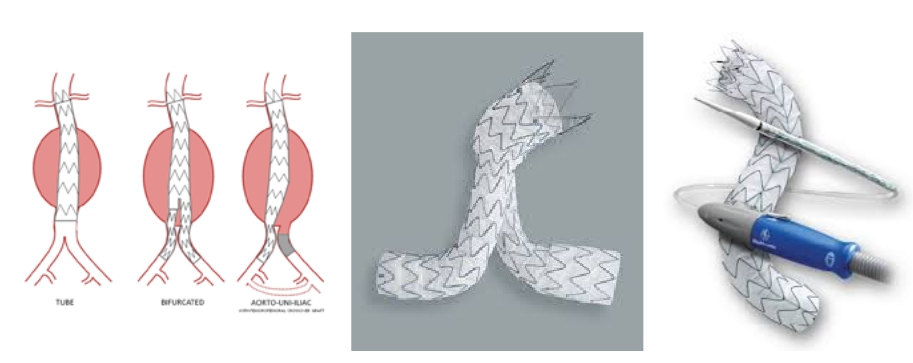
Protezele endovasculare destinate AAA
Protezele endovasculare sunt dispozitive alcătuite dintr–un exoschelet metalic și un tub sintetic.
Exoscheletul este confecționat din inele metalice arcuate din oțel sau nitinol, un aliaj termoplastic de nichel cu titan. Recent au fost introduse și inele din crom–nichel.
Tubul sintetic este confecționat dintr-un polimer biocompatibil (Politetrafluoretilen extrudat – ePTFE sau Politereftelat de etilenglicol – DACRON).
Ele pot fi liniare pentru montaj aortoaortic liniare conice pentru montaj aortouniiliac, dar cel mai frecvent sunt bifurcate.
Dispozitivul este compactat într–o teacă, aceasta fiind conectată cu un sistem de livrare. El este deschis în interiorul anevrismului și apoziționat la peretele aortic și la peretele vascular al celor două a.a. iliace prin forța radială a stenturilor metalice. La protezele cu exoschelet de nitinol forța radială este augmentată datorită caracterului termoplastic al aliajului: acesta dilatându–se marcat la temperatura de 37 grd., caracteristică mediului intern(8).
La unele tipuri (Ovattion) corpul principal al protezei se poate etanșa suplimentar prin intermediul unor inele care se umplu cu un polimer siliconic.
Procedura de implantare
Endoprotezarea aortică pentru AAA este o procedură intervențională nonchirurgicală. Ea se desfășoară în sala de angiografie și este ghidată radiologic.
 Pacientul este plasat în decubit dorsal pe masa angiografului. Este monitorizat invaziv, folosind abord radial dr. pentru TA medie sângerândă și cateter venos jugular intern. Anestezia poate fi generală, dar procedura este făcută de obicei doar cu anestezie locală și pacientul treaz.
Pacientul este plasat în decubit dorsal pe masa angiografului. Este monitorizat invaziv, folosind abord radial dr. pentru TA medie sângerândă și cateter venos jugular intern. Anestezia poate fi generală, dar procedura este făcută de obicei doar cu anestezie locală și pacientul treaz.
Abordul vascular se face prin puncție percutanată a celor două a.a. femurale.
Primul este avansat un cateter diagnostic (pig tail) în aorta abdominală subdiafragmatică și este practicată o angiografie pentru reperarea a.a. renale.
Apoi se avansează corpul principal al protezei pe un ghid dur (Landerquist extrastiff guide wire) și se poziționează sub emergența arterelor renale la nivelul coletului anevrismal. Tecile vasculare au diametre cuprinse între: 16F și 24F.
Pasul următor este canularea și inserția ramurilor care se etanșează prin expandare la nivelul iliacelor comune înainte de bifurcația iliacă reperată angiografic.
Procedura continuă prin umflarea unui balon de angioplastie la nivelul zonelor de apoziție aortică și iliacă bilateral și realizarea sigilării complete.
Procedura se încheie cu o angiografie de control care trebuie să evidențieze permeabilitatea montajului, a celor două a.a. renale și a vaselor viscerale precum și permeabilitatea distală a a.a. iliace interne și externe(8).
Pentru succesul procedurii este importantă existența zonelor de sigilare la nivel aortic subrenal (colet) și la nivel iliac bilateral. Se consideră o lugime de 2 cm ca fiind suficientă.
Există și stent-grafturi fenestrate (FEVAR) care pot fi plasate deasupra emergenței arterelor renale și chiar a tuturor arterelor viscerale, conexiunea acestora făcându-se prin intermediul unor stentgrafturi separate(9),(10).
Procedurile chirurgicale combinate de debranching și implantarea de stent-grafturi endoaortice extind și mai mult posibilitățile de aplicare a acestei tehnici(11).

Diverse tehnici adjuvante au fost propuse pentru tratarea anevrismelor aortei abdominale. Una din variante este injectarea în sacul anevrismal de diversi polimeri. Sistemul Endologix Nellix (Endologix, Irvine, CA) folosește două pungi de endopolimer PTFE care sunt introduse în sacul anevrismal cu rolul de a ocupa spațiul și de a ”îngheța” anevrismul, prevenind astfel continuarea expansiunii acestuia.
Aceste tehnologii sunt încă în fazele incipiente de dezvoltare și nu fac parte din tehnicile de rutină(12).
Este foarte important, deasemeni, demonstrarea etanșeității protezei la locurile de sigilare și absența endo–leakurilor ceea ce realizează excluderea anevrismului din circulație.
Procedura se încheie prin închiderea locurilor de puncție folosind dispozitive percutanate (Proglide sau Angioseal).
EVAR a fost efectuat pentru prima dată de Nicholas Volodos în 1987 în Ucraina(13).
Prima serie a fost publicată de Juan Carlos Parodi în 1991. Ulterior a căpătat o extindere globală(14, 15).
Evaluare preoperatorie
Anevrismele aortei abdominale sunt descoperite în cea mai mare parte la un examen ecografic abdominal sau CT abdominal efectuat pentru altă patologie.
Uneori anevrismele sunt simptomatice prin dureri abdominale sau lombare care iradiază caracteristic pe traiectul ureterelor în zona scrotului la bărbat sau a vaginului la femeie.
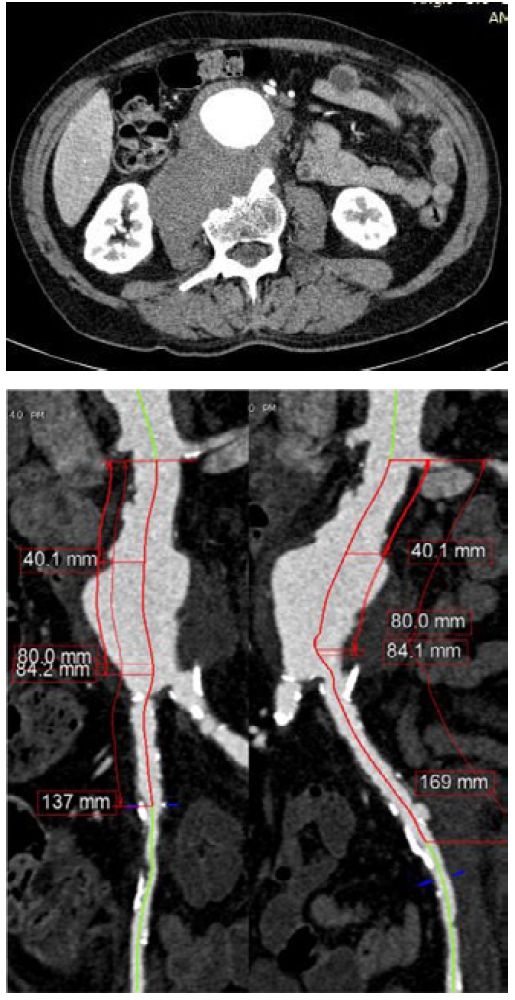 Dacă diametrul maxim este mai mare de 5.5 cm este indicată evaluarea suplimentară pentru stabilirea oportunității de efectuare a unei proceduri EVAR.
Dacă diametrul maxim este mai mare de 5.5 cm este indicată evaluarea suplimentară pentru stabilirea oportunității de efectuare a unei proceduri EVAR.
Pentru a stabili posibilitatea și strategia procedurii, investigația de elecție este Angiografia CT cu reconstrucție digitală tridimensională.
Sunt astfel evaluate, pe lângă morfologia și dimensiunea anevrismului, dimensiunea, forma și orientarea coletului anevrismal subrenal precum și dimensiunea și calitatea a.a. iliace comune. Este important ca aceste zone de sigilare să fie corespunzătoare pentru a obține etanșarea protezei și excluderea anevrismului. În situația unui colet subrenal insuficient (mai scurt de 15 mm) sau cu pereți neparaleli, încărcați cu plăci de aterom, cu tromboză parietală sau cu un unghi mai mare de 60 grd în raport cu aorta suprarenală trebuie luată în considerare alternativa chirurgicală. Deasemeni existența anevrismelor iliace poate orienta strategia.
Măsurătorile sunt importante iar stent-grafturile sunt alese să aibă o lungime adecvată pentru suprapunere suficientă a componentelor modulare.
De asemenea, este important ca orice comorbiditate constatată să fie luată în calcul și analizată în stabilirea strategiei și momentului operator optim(16).
Complicații
Complicațiile procedurii EVAR sunt precoce și tardive.
Diferite studii randomizate controlate au arătat o rată de complicații cu 10-20% mai mare pentru EVAR în raport cu chirurgia deschisă(17).
Complicațiile precoce:
Sângerarea sau hematomul la locurile de puncție sunt relativ rare. Acestea pot fi rezolvate de cele mai multe ori intervențional.
Deasemeni ocluzia unuia sau ambelor ramuri ale protezei cu ischemie acută consecutivă poate surveni în primele ore postprocedural și are un caracter de severitate deosebită, cu risc letal.
Această situație poate fi datorată cudurii protezei sau existenței unei descărcări distale insuficiente. Rezolvarea este de obicei chirurgicală prin by pass extraanatomic axilobifemural.
Insuficiența renală acută poate fi consecința astupării ostiilor arterelor renale cu corpul principal al protezei sau consecința administrării excesive de substanță de contrast. În prima situație, extirparea protezei este evident necesară, pe când în a doua, tratamentul substitutiv al funcției renale poate fi suficient.
Pe termen mediu și lung poate apărea scurgerea de sânge în interiorul sacului anevrismal (endo leak–uri). Dacă aceasta se produce la nivelul zonelor de sigilare, se numesc endo leak de Grd I. Ele sunt de obicei restante de la momentul procedurii dar pot surveni și ulterior. Sângerările intraanevrismale generate de colaterale sunt denumite endo leak–uri de Grd II. Ambele tipuri au de obicei soluții intervenționale folosind postdilatări cu balon sau embolizări.
Scurgerile de sânge la locul de conexiune al modulelor (endo leak de gr III) sau prin țesătura protezei (endo leak de grd IV) se tratează prin inserția de endoproteze suplimentare.
Există și scurgeri intraanevrismale cu origine imposibil de identificat (endo leak de gr IV) a căror rezolvare implică o abordare chirurgicală deschisă.
În general persistența creșterii diametrelor anevrismului după EVAR implica o atitudine promptă intervențională sau chirurgicală(18).
Nu neapărat în ultimul rând, infecția endoprotezei este o complicație redutabilă care impune extirparea ei chirurgicală.
Urmărirea posprocedurală a pacienților cu EVAR.
Așa cum am arătat, evoluția postprocedurală a pacienților cu EVAR poate fi grevată de anumite complicații.
Registrul EUROSTAR a raportat rezultatele EVAR și a evidențiat rate de reintervenție la 1, 2, 3 și 4 ani de 6%, 9%, 12% și respectiv 14%(19).
S-a dovedit că post EVAR peretele anevrismal se atrofiază și diametrul saculului se oprește din creștere. Acest fapt se datorează scăderii presiunii din anevrism odată cu suprimarea alimentării arteriale. Deasemeni, tromboza parietală se extinde și în cazurie ideale, devine completă.
Dacă există o represurizare tardivă a anevrismului din cauza endoleak-ului, atunci poate apărea ruptura. Ruptura este o urgență la orice pacient post-EVAR care se prezintă cu dureri abdominale acute cu sau fără colaps cardiovascular.
În studiile EVAR din Marea Britanie au un fost raportate un total de 27 de rupturi post-EVAR. Optzeci și doi la sută din aceste rupturi au apărut la mai mult de 30 de zile de la implantare și majoritatea dintre acestea (63%) au fost la pacienți cu complicații sau semne de EVAR eșuate raportate anterior(20).
De asemenea, într-o recenzie din literatura de specialitate Schlösser a raportat un număr de 270 de rupturi post EVAR. În această serie 35 de pacienți au avut complicații post EVAR constatate în timpul urmăririi, 39/101 pacienții cu ruptură nu au prezentat nicio modificare a diametrului anevrismului în timpul urmăririi, iar 26/101 au arătat dovezi ale regresiei anevrismului.Cercetările au identificat endoleak -ul de tip I și II (cu mărirea sacului anevrismal), migrarea și cudura grefei ca factori de risc pentru ruptura tardivă a peretelui aortic.
La toți pacienții cu risc de rupere a peretelui anevrismal post EVAR se recomandă un follow-up regulat prin angio CT, în special la cei la care o intervenție secundară este luată în considerare.
Protocoalele actuale de supraveghere a pacienților cu EVAR se bazează pe Angiografia CT cu reconstrucție tridimensională efectuată la 1, 6 și 12 luni postprocedural și apoi anual.
Datorită costurilor, accesibilității limitate a metodei, expunerii la radiații și administrării de substanțe de contrast nefrotoxice, a fost propusă ecografia abdominală combinată cu radiografia abdominală simplă (AXR) pentru urmărirea pe termen lung a pacienților cu evoluție evident necomplicativă(21).
Concluzii
În patologia anevrismală a aortei abdominale și toracoabdominale, standardul de aur a fost chirurgia deschisă pentru 50 ani.
Rezultatele acesteia au devenit foarte bune, totuși, intervențiile chirurgicale ample cu evoluție prelungită în terapie intesivă și în spital și suferința importantă a pacientului, a condus la dezvoltarea tehnicilor endovasculare(22).
În ultimii 20 de ani, numărul de pacienți tratați prin EVAR/FEVAR a crescut constant.
Protezele endovasculare au evoluat permanent fiind din ce în ce mai eficiente și totodată fiind din ce în ce mai facil de implantat.
Limitele anatomice ale leziunilor s-au extins, astăzi putând fi tratați endovascular un număr din ce în ce mai mare de pacienți.
Deasemeni pot fi abordate pe lângă anevrisme și alte patologii-disecții aortice de tip B, secțiuni traumatice sau chiar fistule aortoenterice.
Un capitol de o mare importanță începe a fi EVAR în urgență pentru anevrisme rupte, soluție care până la sfârșitul acestui an se consideră că va deveni prima opțiune de ghid(23).
Bibliografie
- Hirsch AT, Haskal ZJ, Hertzer NR, et al. ACC/AHA 2005 Practice Guidelines for the management of patients with peripheral arterial disease (lower extremity, renal, mesenteric, and abdominal aortic): A collaborative report from the American Association for Vascular Surgery/Society for Vascular Surgery, Society for Cardiovascular Angiography and Interventions, Society for Vascular Medicine and Biology, Society of Interventional Radiology, and the ACC/AHA Task Force on Practice Guidelines (Writing Committee to Develop Guidelines for the Management of Patients With Peripheral Arterial Disease): Endorsed by the American Association of Cardiovascular and Pulmonary Rehabilitation; National Heart, Lung, and Blood Institute; Society for Vascular Nursing; Trans-Atlantic Inter-Society Consensus; and Vascular Disease Foundation. Circulation. 2006;113:e463–e654.
- Silverberg E, Boring CC, Squires TS. Cancer statistics, 1990. CA Cancer J Clin. 1990;40:9–26.
- McPhee JT, Hill JS, Eslami MH. The impact of gender on presentation, therapy, and mortality of abdominal aortic aneurysm in the United States, 2001–2004. J Vasc Surg. 2007;45:891–9.
- Fleming C, Whitlock EP, Beil TL, et al. Screening for abdominal aortic aneurysm: A best-evidence systematic review for the US Preventive Services Task Force. Ann Intern Med. 2005;142:203–11.
- Dubost, C; Allary, M; Oeconomos, N (1952). „Resection of an aneurysm of the abdominal aorta: reestablishment of the continuity by a preserved human arterial graft, with result after five months”. AMA Arch Surg. 64 (3): 4058. doi:10.1001/archsurg.1952.01260010419018. PMID 14894065
- Isselbacher EM. Thoracic and abdominal aortic aneurysms. Circulation. 2005;111:816–28.
- Brewster DC, Cronenwett JL, Hallett JW, Jr, et al. Guidelines for the treatment of abdominal aortic aneurysms. Report of a subcommittee of the Joint Council of the American Association for Vascular Surgery and Society for Vascular Surgery. J Vasc Surg. 2003;37:1106–17.
- Maher M M, McNamara A M, MacEneaney P M, Sheehan S J, Malone D E. Abdominal aortic aneurysms: elective endovascular repair versus conventional surgery—evaluation with evidence-based medicine techniques. Radiology. 2003;228:647–658.
- O’Neill S, Greenberg R K, Haddad F, Resch T, Sereika J, Katz E. A prospective analysis of fenestrated endovascular grafting: intermediate-term outcomes. Eur J Vasc Endovasc Surg. 2006;32:115–123.
- Haddad F, Greenberg R K, Walker E, et al. Fenestrated endovascular grafting: the renal side of the story. J Vasc Surg. 2005;41:181–190.
- Muhs B E, Verhoeven E LG, Zeebregts C J, et al. Mid-term results of endovascular aneurysm repair with branched and fenestrated endografts. J Vasc Surg. 2006;44:9–15.
- Semmens J B, Lawrence-Brown M MD, Hartley D E, Allen Y B, Green R, Nadkarni S. Outcomes of fenestrated endografts in the treatment of abdominal aortic aneurysm in Western Australia (1997–2004) J Endovasc Ther. 2006;13:320–329
- Volodos NL, Karpovich IP, Shekhanin VE, Troian VI, Iakovenko LF. [A case of distant transfemoral endoprosthesis of the thoracic artery using a self-fixing synthetic prosthesis in traumatic aneurysm]. Grudn Khir 1988;(6):84-6.
- Parodi JC, Palmaz JC, Barone HD. Transfemoral intraluminal graft implantation for abdominal aortic aneurysms. Ann Vasc Surg 1991;5(6):491-9.
- Juan Carlos Parodi, MD, Andrea Barone, MD, et al. Endovascular Treatment of Abdominal Aortic Aneurysms: Lessons Learned. Journal of endovascular terapy Volume 4, Issue 2 1991
- Metcalfe D, Holt PJ, Thompson MM. The management of abdominal aortic aneurysms. BMJ 2011;342:d1384.
- De Bruin JL, Baas AF, Buth J, Prinssen M, Verhoeven EL, Cuypers PW, et al. Long-term outcome of open or endovascular repair of abdominal aortic aneurysm. N Engl J Med 2010;362(20):1881-9.
- White GH, Yu W, May J. Endoleak–a proposed new terminology to describe incomplete aneurysm exclusion by an endoluminal graft. J Endovasc Surg 1996;3(1):124-5.
- Hobo R, Buth J, EUROSTAR collaborators. Secondary interventions following endovascular abdominal aortic aneurysm repair using current endografts. A EUROSTAR report. J Vasc Surg 2006;43(5):896-902.
- Brown LC, Greenhalgh RM, Powell JT, Thompson SG, EVAR Trial Participants. Use of baseline factors to predict complications and reinterventions after endovascular repair of abdominal aortic aneurysm. Br J Surg 2010;97(8):1207-17.
- United Kingdom EVAR Trial Investigators, Greenhalgh RM, Brown LC, Powell JT, Thompson SG, Epstein D, et al. Endovascular versus open repair of abdominal aortic aneurysm. N Engl J Med 2010;362(20):1863-71.
- De Bruin JL, Baas AF, Buth J, Prinssen M, Verhoeven EL, Cuypers PW, et al. Long-term outcome of open or endovascular repair of abdominal aortic aneurysm. N Engl J Med 2010;362(20):1881-9.
- Improve Trial, Powell JT, Thompson SG, Thompson MM, Grieve R, Nicholson AA, et al. The Immediate Management of the Patient with Rupture: Open Versus Endovascular repair (IMPROVE) aneurysm trial— ISRCTN 48334791 IMPROVE trialists. Acta Chir Belg 2009;109(6):678-80.
 Prof. Univ. Dr. Habil Horațiu Moldovan
Prof. Univ. Dr. Habil Horațiu Moldovan
