The utility of ultrasonographic endoscopy (echoendoscopy) in the diagnosis of pancreatic tumors
Endoscopia ultrasonografică (ecoendoscopia) reprezintă o tehnică imagistică complexă care permite examinarea peretelui tubului digestiv și a organelor de vecinătate. Prin combinarea a două investigații simple (endoscopia + ultrasonografia) a luat naștere în 1980 ecoendoscopia, explorare de înaltă rezoluție care a deschis o nouă dimensiune a investigațiilor imagistice. Noua procedură endoscopică a apărut din necesitatea de a avea o metodă mai bună și mai precisă de a examina aparatul bilio-pancreatic, însă în timp au fost dezvoltate multiple alte aplicații.
Primul ecoendoscop a fost unul radial, cu sonda de ecograf în vârful endoscopului, care oferea o imagine 360ﹾ si o analiză în timp real a anatomiei. La câțiva ani distanță, a fost produsă și prima versiune de ecoendoscop linear, cu imagine 180ﹾ, având avantajul unei rezoluții mai bune și efectuarea de proceduri intervenționale de tipul puncției fine aspirative bioptice.

Încă de la începuturi, capacitățile diagnostice ale ecoendoscopiei se anunțau a fi impresionante, datorită imaginilor detaliate, dar și a posibilității de a analiza îndeaproape structurile și raporturile. Ecoendoscopia permite o stadializare precisă a gradului T (tumoră) și N (ganglioni) în cazul tumorilor din sfera pancreatico-biliară și digestivă superioară. Marea revoluție a ecoendoscopiei a venit însă o dată cu producerea acelor de biopsie. Inițial au fost produse cele pentru puncția fină aspirativă (Fine Needle Aspiration [FNA]) iar apoi cele pentru puncția fină de tip “histologic” (Fine Needle Biopsy [FNB]). Astfel impactul asupra capacității de diagnostic în special pentru tumorile pancreatice a crescut exponențial [1]. Putem spune ca discutăm astăzi despre o tehnică medicală inovatoare, care a schimbat radical modul în care medicii diagnostichează și monitorizează afecțiunile pancreatice
Pancreasul este un organ parenchimatos, retroperitoneal, situat în etajul abdominal superior, având raporturi intime cu numeroase organe și structuri vasculare. Din cauza profunzimii și a raporturilor este dificil de vizualizat in întregime prin ecografia transabdominală și greu de abordat în cazul intervențiilor chirurgicale. Prezinta dublă funcție secretorie: endocrină și exocrină – esențiale în menținerea homeostaziei. În ultimele decenii incidența neoplaziilor pancreatice este în creștere.
Formațiunile neoplazice ale pancreasului se pot împărți în:
- Tumori benigne și premaligne: tumora solidă pseudopapilară, chistadenoame seroase / mucinoase
- Tumori maligne exocrine: adenocarcinomul ductal, chistadenocarcinomul, etc.
- Tumori maligne endocrine (NET): insulinom, gastrinom etc.
Majoritatea tumorilor maligne pancreatice sunt forme agresive cu evoluție rapida, cu invazii în structurile de vecinătate și metastazare precoce. Diagnosticul precoce al tumorilor pancreatice este esențial pentru îmbunătățirea prognosticului și pentru a crește rata de supraviețuire a pacienților. În acest proces, ecoendoscopia a devenit un element cheie care permite prelevarea de probe în scopul efectuării examenului histopatologic indispensabil inițierii tratamentului corespunzător [2].
Tehnică de examinare
Procedura este realizată sub sedare profundă, cu pacientul à jeun cu cel puțin 6-8h înaintea procedurii, în poziția de decubit lateral stâng. Avansarea până la nivelul stomacului sau duodenului se face sub control vizual folosind imaginea endoscopică. Ulterior, se utilizează imaginea ecografică. Odată identificată formațiunea suspectă, examinarea se poate face în mai multe moduri imagistice:
- Modul bidimensional: permite analiza structurii, ecogenității, raporturilor, omogenității si dimensiunilor; realizează o descriere detaliată a anatomiei leziunii [3].
- Modul Doppler: permite analiza gradului de vascularizație a țesutului tumoral. De asemenea, este foarte util pentru ghidarea puncțiilor – se alege planul cu cele mai puține vase pentru a reduce riscul unei sângerări post-procedurale.
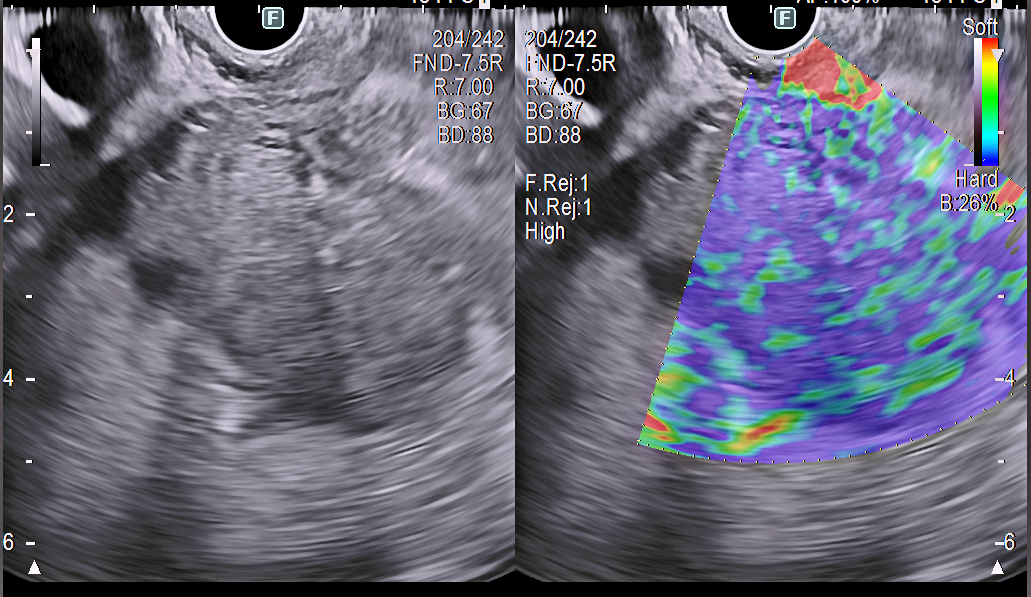
- Modul elastografic: este asemănător unei “palpări virtuale” a pancreasului și a formațiunii suspecte cu ajutorul unei hărți de culoare (elastogramă) suprapusă imaginii 2D. Se poate evalua daca structura identificată este dură sau moale, în raport cu țesutul pancreatic din jur. De regulă, formațiunile tumorale sunt mai dure decât țesutul pancreatic neafectat.
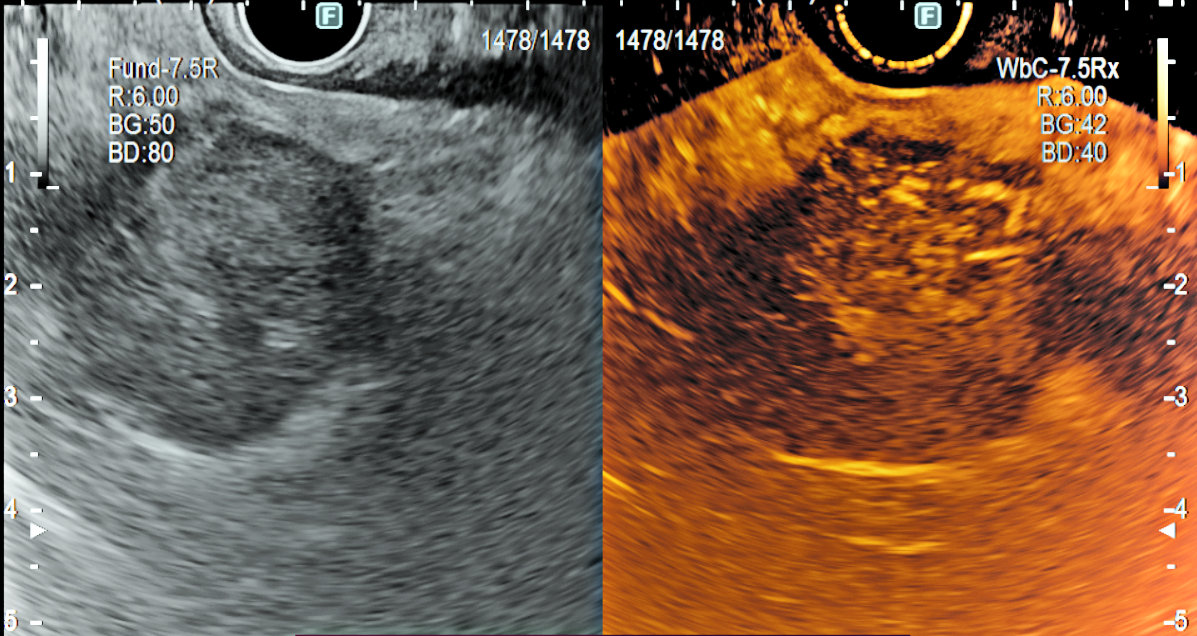
Modul ecografic îmbunătățit cu contrast (CEUS):
- Folosește o substanță de contrast realizată din microbule de hidrofluorură de sulf (gaz inerent, inofensiv și hipoalergen) care se injectează in timpul folosirii modului ecografic harmonic. Astfel, se analizează structurile prin prisma microvascularizației; permite analiza pattern-ului de captare a substanței de contrast la nivelul formațiunii și a țesutului înconjurător, pe baza acestuia putând formula o ipoteza diagnostică.
- De asemenea, ajuta la delimitarea clară a structurilor atunci când imaginea in modul bidimensional nu este una optimă.
- Este extrem de util pentru ghidarea puncțiilor-biopsie, evidențiind vascularizația mai precis ca modul Doppler și arată existența zonelor de necroză care trebuie evitate, întrucât acestea au probabilitate crescută pentru un rezultat anatomopatologic fals [4].
După o analiză detaliată a structurilor anatomice și a leziunilor suspecte, se efectuează puncția acestora. Acele de biopsie variază in diametru și sunt special concepute pentru acest tip de proceduri. Acul este localizat într-o teacă de protecție si se introduce împreună cu teaca prin canalul de lucru. La nivelul canalului de biopsie al ecoendoscopului, se atașează un mâner de control pentru acul de biopsie. Acul are un lumen interior ocupat de un stilet retractabil. Acest stilet, cât timp este introdus complet, transforma acul într-unul atraumatic si previne puncționarea accidentală a țesuturilor.

Pentru a crește rata de detecție, sunt recomandate 2-3 pasaje cu acul în diferite planuri ale tumorii. În fiecare plan puncționat se fac multiple treceri în “evantai” pentru a preleva cât mai mult țesut. Fragmentele prelevate se colectează în interiorul acului.
Pentru a aspira fragmentele prelevate in interiorul acului se pot folosi mai multe tehnici:
- Dry suction – la capătul extern al mânerului de control se montează o seringa tip vacuum care, in momentul cuplării la ac, creează un mediu de sucțiune.
- Slow pull – constă în retragerea progresivă a stiletului din ac pe măsura efectuării trecerilor prin tumoră. Astfel, se creează o presiune negativă minimă în interiorul acului care aspiră fragmentele.
- Wet suction – constă în spălarea acului cu soluție salină, urmata de conectarea unei seringi de aspirație preumplută cu aceeași soluție salină. Folosește același principiu cu cel al aspirării simple, avand in schimb un mediu lichid în locul aerului. Studiile recente arată că aceasta ar putea fi tehnica cu cea mai mare rata de succes [5].

Fragmentele prelevate sunt supuse examenului citologic direct pe lamă si așezate în medii cu formol pentru examenul histopatologic. Stabilirea diagnosticului final necesită o buna colaborare interdisciplinară cu serviciul de Anatomie Patologică.
După efectuarea biopsiilor, ecoendoscopul este îndepărtat cu atenție, iar pacientul va rămâne sub supravegherea medicală cel puțin 12 ore.
Contraindicații
- Tulburări severe de coagulare, din cauza riscurilor crescute de sângerare intra și postprocedurală.
- Tratament antiagregant sau anticoagulant cronic. Acesta se suspendă anterior intervenției pentru o durata variabilă de timp în funcție de anticoagulantul administrat.
- Anatomia digestivă modificată care poate face introducerea endoscopului dificilă sau periculoasă.
- Reacții alergice la anestezice sau la alte substanțe folosite în timpul procedurii [6].
Riscuri și complicații
Într-o meta-analiză recent publicată, rata complicațiilor post biopsie FNA a fost de 0.98%, iar cea de deces de 0,02%. Aceste procente pot varia în funcție de diametrul acului utilizat și de experiența medicului care efectuează procedura [7].
- Sângerare: variază în funcție de tipul leziunii puncționate, de experiența examinatorului, de diametrul acului de biopsie și de existența tulburărilor de coagulare. Însă trebuie specificat faptul că în general apar mici sângerări cu rezoluție spontană, hemoragiile severe fiind extrem de rare.
- Infecții: exista cazuri descrise în literatură, însă acestea sunt destul de rare. Cel mai adesea apar bacteriemii tranzitorii. În cadrul a trei studii prospective care au evaluat acest aspect, incidența a fost de aproximativ 2%. Ghidurile ASGE nu recomandă profilaxia antibiotică de rutină pentru prevenția infecțiilor, rata acestora fiind foarte mică [9].
- Perforația tubului digestiv superior: complicație extrem de rară, acele folosite în acest moment fiind special concepute pentru a preveni astfel de evenimente. Cu toate acestea, o perforație produsa in timpul ecoendoscopiei nu mai reprezintă întotdeuna o urgență chirurgicală; defectul poate fi închis în timpul aceleiași proceduri prin montarea unui clip ”over the scope” [10].
- Pancreatita acută: poate apărea dacă acul lezează Wirsung-ul sau ductele secundare. Un studiu din SUA în care au fost înrolați 4909 pacienți cu biopsie pancreatică ecoendoscopică tip FNA a decelat 14 cazuri (0,29%) de pancreatită acută dintre care majoritatea au fost forme ușoare [11].
- Însămânțarea neoplazică a traiectului de puncție: este, de asemenea, extrem de rară [12].
Rezultate
În cadrul evaluării ecoendoscopice a unei formațiuni pancreatice, obiectivele sunt:
- Identificare argumentelor in favoarea originii benigne sau maligne a leziunii prin intermediul analizei imaginilor ultrasonografice în mod bidimensional, Doppler, elastografic si armonic.
- Stadializarea extensiei tumorale, excluderea existenței invaziei la nivelul structurilor si vaselor de vecinătate.
- Prelevarea de biopsii cu pasaje în diferite planuri tumorale cu ajutorul tehnicii ultrasonografice pentru alegerea zonelor viabile și evitarea zonelor de necroză.
- Evaluare ganglionilor juxtapancreatici și din regiunea celiacă. Există criterii imagistice care pot indica infiltrarea neoplazică (ganglionii neomogeni, ovalari, duri din punct de vedere elastografic). Aceștia pot fi biopsiați in vederea stadializării N a tumorii.
- Pentru leziunile chistice pancreatice se poate preleva material lichidian si tisular care se analizează ulterior citologic și biochimic în vederea stabilirii caracterului benign sau malign.
Tratament
Aceasta metodă imagistică este utilă și pentru urmărirea tumorilor post-chimioterapie în vederea evaluării răspunsului terapeutic, sau post rezecție pancreatică pentru decelarea eventualelor recidive. În cazurile depășite terapeutic, ecoendoscopia poate fi folosită în scopuri paliative: anastomoze biliodigestive pentru drenaj, anastomoze gastro-jejunale care să permită continuarea alimentației orale sau neuroliza plexului celiac în paliația durerii [13].
În ultimii ani, cu ajutorul biopsiilor prelevate ecoendoscopic din tumorile pancreatice, echipele de cercetare încearcă analiza detaliată citologică, biochimică și genetică pentru a obține noi informații revelatoare în încercarea de a oferi tratamente țintite și individualizate fiecărui pacient.
Concluzii
Ecoendoscopia a revoluționat modul în care putem diagnostica și trata tumorile pancreatice. Procedura este ușor de tolerat de către pacient sub sedare profundă, iar rata complicațiilor este redusă. Această investigație oferă avantaje semnificative pentru detectarea precoce, evaluarea extensiei tumorale și ghidarea tratamentului.
Pentru pacienții cu suspiciune de tumori pancreatice sau cu afecțiuni pancreatice cunoscute, ecoendoscopia reprezintă metoda de primă intenție pentru obținerea unui diagnostic precis și pentru planificarea tratamentului adecvat. Pe măsură ce tehnologia continuă să avanseze, ecoendoscopia va juca un rol tot mai important în gestionarea acestor afecțiuni, oferind speranță și îmbunătățind calitatea vieții pacienților.
Bibliografie
- Cazacu, I. M., Luzuriaga Chavez, A. A., Saftoiu, A., Vilmann, P., & Bhutani, M. S. (2018). A quarter century of EUS-FNA: Progress, milestones, and future directions. Endoscopic ultrasound, 7(3), 141–160. https://doi.org/10.4103/eus.eus_19_18
- Bornman PC, Beckingham IJ. ABC of diseases of liver, pancreas, and biliary system. Pancreatic tumours. BMJ. 2001 Mar 24;322(7288):721-3. doi: 10.1136/bmj.322.7288.721.
- Rana A, Rana SS. Endoscopic Ultrasound-Guided Tissue Acquisition: Techniques and Challenges. J Cytol. 2019 Jan-Mar;36(1):1-7. doi: 10.4103/JOC.JOC_146_18.
- Bartolotta TV, Randazzo A, Bruno E, Alongi P, Taibbi A. Focal Pancreatic Lesions: Role of Contrast-Enhanced Ultrasonography. Diagnostics (Basel). 2021 May 26;11(6):957. doi: 10.3390/diagnostics11060957.
- Ramai D, Singh J, Kani T, Barakat M, Chandan S, Brooks OW, Ofosu A, Khan SR, Dhindsa B, Dhaliwal A, Quintero EJ, Cheung D, Facciorusso A, McDonough S, Adler DG. Wet- versus dry-suction techniques for EUS-FNA of solid lesions: A systematic review and meta-analysis. Endosc Ultrasound. 2021 Sep-Oct;10(5):319-324. doi: 10.4103/EUS-D-20-00198.
- Mekky MA, Abbas WA. Endoscopic ultrasound in gastroenterology: from diagnosis to therapeutic implications. World J Gastroenterol. 2014 Jun 28;20(24):7801-7. doi: 10.3748/wjg.v20.i24.7801.
- Mizuide M, Ryozawa S, Fujita A, Ogawa T, Katsuda H, Suzuki M, Noguchi T, Tanisaka Y. Complications of Endoscopic Ultrasound-Guided Fine Needle Aspiration: A Narrative Review. Diagnostics (Basel). 2020 Nov 17;10(11):964. doi: 10.3390/diagnostics10110964
- Jang, D. K., & Lee, S. H. (2018). The Bleeding Risk after Endoscopic Ultrasound-Guided Fine Needle Aspiration in Patients Taking Antithrombotic Agents Is Not Negligible. Gut and liver, 12(3), 225–226. https://doi.org/10.5009/gnl18103
- Levy, M. J., Norton, I. D., Wiersema, M. J., Schwartz, D. A., Clain, J. E., Vazquez-Sequeiros, E., Wilson, W. R., Zinsmeister, A. R., & Jondal, M. L. (2003). Prospective risk assessment of bacteremia and other infectious complications in patients undergoing EUS-guided FNA. Gastrointestinal endoscopy, 57(6), 672–678. https://doi.org/10.1067/mge.2003.204
- Bournet, B., Migueres, I., Delacroix, M., Vigouroux, D., Bornet, J. L., Escourrou, J., & Buscail, L. (2006). Early morbidity of endoscopic ultrasound: 13 years’ experience at a referral center. Endoscopy, 38(4), 349–354. https://doi.org/10.1055/s-2005-921173
- Hirooka, Y., Goto, H., Itoh, A., Hashimoto, S., Niwa, K., Ishikawa, H., Okada, N., Itoh, T., & Kawashima, H. (2003). Case of intraductal papillary mucinous tumor in which endosonography-guided fine-needle aspiration biopsy caused dissemination. Journal of gastroenterology and hepatology, 18(11), 1323–1324. https://doi.org/10.1046/j.1440-1746.2003.03040.x
- Paquin, S. C., Gariépy, G., Lepanto, L., Bourdages, R., Raymond, G., & Sahai, A. V. (2005). A first report of tumor seeding because of EUS-guided FNA of a pancreatic adenocarcinoma. Gastrointestinal endoscopy, 61(4), 610–611. https://doi.org/10.1016/s0016-5107(05)00082-9
- Sbeit W, Napoléon B, Khoury T. Endoscopic ultrasound role in pancreatic adenocarcinoma treatment: A review focusing on technical success, safety and efficacy. World J Gastroenterol. 2022 Jan 21;28(3):332-347. doi: 10.3748/wjg.v28.i3.332.
 Dr. Sorin Coman
Dr. Sorin Coman
