The Mitral Valve in Hypertrophic Obstructive Cardiomyopathy
Abstract: Beside the asymmetric hypertrophy of the left ventricle, a near constant anomaly has been described in hypertrophic obstructive cardiomyopathy (HOCM), and that is a modified mitral valvular apparatus. Most patients diagnosed with HOCM have redundant and variably thickened mitral leaflets. There has been extensive debate if these modifications of the mitral valve are caused by the asymmetric hypertrophy of the left ventricle, with adaptation of the valve collagen structure, or a phenotypical expression of the disease. Currently, the abnormalities of the mitral valve are considered primary phenotypical expressions of this complex cardiac disease. These anomalies can interest any component of the mitral valve apparatus: the leaflets, the cordae tendinae, or the papillary muscles.
Pe lângă hipertrofia asimetrică a ventriculului stâng (VS), o anomalie aproape constantă s-a descris în cardiomiopatia hipertrofică obstructivă (CMHO), și anume un aparat valvular mitral modificat. Majoritatea pacienților diagnosticați cu CMHO au cuspele valvei mitrale (VM) îngroșate în mod variabil și sunt redundante. Multă vreme au fost dezbateri dacă aceste modificări ale VM sunt consecința hipertrofiei asimetrice a VS cu adaptarea structurii de colagen a valvei sau o expresie fenotipică a CMH. Actual, anomaliile aparatului mitral sunt considerate expresii fenotipice primare ale acestei boli cardiace complexe. Aceste anomalii pot interesa orice componentă a aparatului mitral.

Se descriu modificări ale cuspelor VM: valva mitrală anterioară (VMA) este deplasată în raport cu valoarea de referință și alungită depășind de obicei 30 mm în comparație cu referința de 25 mm (în cazuri rare a fost descrisă VMA de peste 40 mm lungime)[1]; valva mitrală posterioară (VMP) are de obicei o lungime mai mare de 17 mm. Alungirea VMA produce un deficit de coaptare deoarece de cele mai multe ori VMP nu este suficient de elongată și de mobilă pentru a se deplasa anterior cu VMA, astfel încât coaptarea nu mai are loc la marginea liberă a cuspelor, iar vârful VMA protruzionează în cavitatea VS în timpul sistolei mult sub planului inelului mitral. Se produce astfel regurgitare mitrală. În timpul mezo-sistolei se produce o angulare ascuțită a VMA către septul interventricular (SIV) – așa numita mișcare sistolică anterioară (systolic anterior motion – SAM), iar după contactul mitro-septal diferența de presiune împinge suplimentar VM în sept (Fig.1).
Fig.1. Ilustrarea forței hemodinamice asupra cuspelor valvei mitrale, în proto-sistolă (A) și mezo-tele-sistolă (B), cu apariția contactului mitro-septal și îngustarea tractul de ejecție al ventriculului stâng [2].
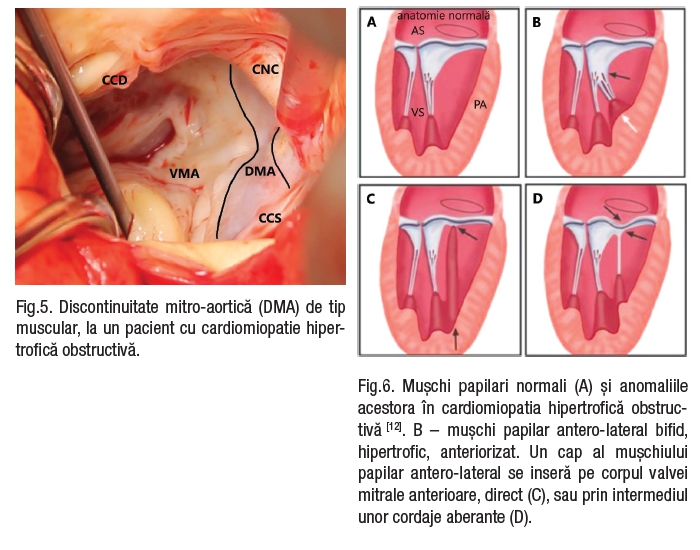
Aparatul subvalvular este la rândul lui modificat. Se descriu anomalii ale mușchilor papilari: deplasarea anterioară și apicală a mușchilor papilari, cu mutarea consecutivă a VMA spre anterior către tractul de ejectie al VS (TEVS)[3,4,5]; hipertrofia mușchilor papilari, a peretelui ventricular posterior sau a SIV poate provoca obstrucție medio-ventriculară[3,4]; creșterea numărului de mușchi papilari este descrisă la aproximativ 50% din pacienții cu CMH[5]; în 13% din cazuri, mușchii papilari sunt inserați direct pe fața ventriculară a VMA[6]. De asemenea, se descriu cordaje secundare fibrotice și retractate ale VMA[7], care tracționează pânza VMA spre SIV, îngustând astfel tractul de ejecție al VS (Fig.2,3).
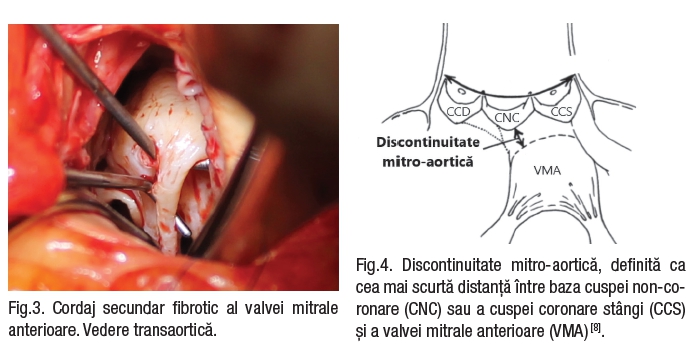
Discontinuitatea mitro-aortică (Fig.4) este o malformație congenitală rar observată. Această anomalie poate fi descoperită în timpul operației fără a fi diagnosticată preoperator. Cuspa anterioară a VM este separată de rădăcina aortică și trigonul fibros intervalvular, iar aceasta poate produce obstrucție subaortică datorită lungimii excesive a VMA. Valva aortică poate fi poziționată anormal superior. De asemenea, s-a observat existența unei discontinuități ample cu un spațiu fibros profund subaortic, baza VMA fiind complet mobilă, „plutind” în partea centrală a TEVS. S-a mai observat prezența depozitelor dispersate de țesut fibros, produse de obstrucția dinamică a TEVS de către VMA elongată.
Fig.4. Discontinuitate mitro-aortică, definită ca cea mai scurtă distanță între baza cuspei non-coronare (CNC) sau a cuspei coronare stângi (CCS) și a valvei mitrale anterioare (VMA) [8].
Discontinuitatea mitro-aortică de tip muscular (Fig.5) a fost recent identificată pentru prima oară la circa 1/4 din pacienții cu CMHO și a fost semnificativ mai frecventă la tineri[9].
Fig.5. Discontinuitate mitro-aortică (DMA) de tip muscular, la un pacient cu cardiomiopatie hipertrofică obstructivă.
În CMHO, anomaliile structurale ale aparatului mitral contribuie la obstrucția TEVS. Aceste modificări ale VM (elongația și deplasarea către anterior a VMA, hipertrofia mușchilor papilari și inserția anormală a acestora) duc la o coaptare deficitară ce se realizează nu între marginile libere a celor două cuspe, ci între corpul cuspelor[2,10]. Cel mai frecvent, VMA are contact cu SIV și obstrucționează TEVS. Rarisim, VMP se extinde anterior de linia de coaptare și contribuie la obstrucția TEVS[11].
Valva mitrală elongată este aspirată în TEVS către septul bazal hipertrofiat, datorită forței de tracțiune dezvoltată odată cu ejecția VS (Fig.1). Pe măsură ce VM are mai mult contact cu SIV, cu atât mai mare este gradientul presional între VS și aortă[2]. În cadrul evaluării pacientului, este importantă măsurarea lungimii ambelor cuspe mitrale. VMA se măsoară de la marginea liberă până la inserția cuspei non-coronare a valvei aortice.
În majoritatea cazurilor, mușchii papilari sunt hipertrofiați iar 13% din pacienții cu CMH au o inserție anormală a mușchilor papilari (Fig.6,7). Se consideră inserție anormală când unul sau ambele vârfuri ale mușchilor papilari se inseră, fără a fi implicate cordajele tendinoase, la vârful, mijlocul sau la baza VMA, sau mai rar pe SIV subaortic. VMA poate fi fixată prin cordaje tendinoase de peretele lateral al VS. Aceste modificări structurale duc la modificări funcționale, VM fiind trasă în TEVS.
Fig.6. Mușchi papilari normali (A) și anomaliile acestora în cardiomiopatia hipertrofică obstructivă [12]. B – mușchi papilar antero-lateral bifid, hipertrofic, anteriorizat. Un cap al mușchiului papilar antero-lateral se inseră pe corpul valvei mitrale anterioare, direct (C), sau prin intermediul unor cordaje aberante (D).
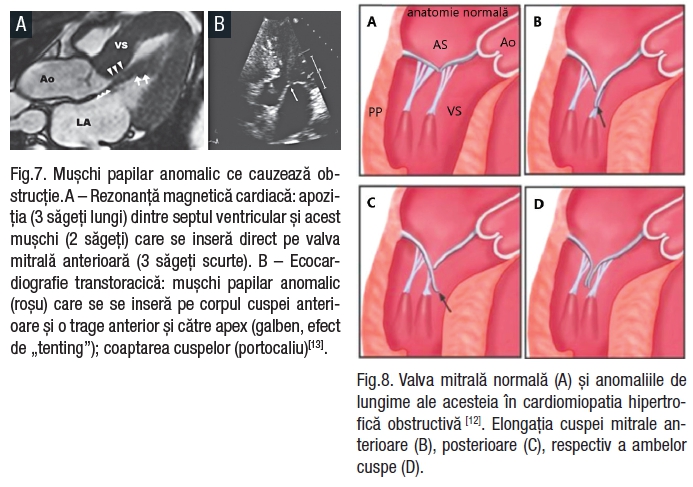
Fig.7. Mușchi papilar anomalic ce cauzează obstrucție. A – Rezonanță magnetică cardiacă: apoziția (3 săgeți lungi) dintre septul ventricular și acest mușchi (2 săgeți) care se inseră direct pe valva mitrală anterioară (3 săgeți scurte). B – Ecocardiografie transtoracică: mușchi papilar anomalic (roșu) care se se inseră pe corpul cuspei anterioare și o trage anterior și către apex (galben, efect de „tenting”); coaptarea cuspelor (portocaliu)[13].
O atenție deosebită trebuie acordată depistării elementelor patologice ale mușchilor papilari care ar putea produce obstrucția TEVS: deplasarea anterioară sau apicală a mușchiului papilar antero-lateral, scurtarea distanței dintre cei doi mușchi papilari, mușchi papilar dublu sau bifid, inserarea directă a mușchiului papilar (fără cordaje) pe VM, mușchi papilar aberant, mușchi papilar antero-lateral hipermobil. Dacă SIV are grosime mai mică de 18 mm, iar gradientul din tractul de ejecție este mare, trebuie verificat dacă inserțiile mușchilor papilari sunt normale.
Unul dintre cele mai importante roluri în procesul fiziopatologic de obstrucție a TEVS la pacienții cu CMHO îl au cuspele valvei mitrale. Mișcarea sistolică anterioară (SAM) a VM și contactul valvei cu SIV hipertrofiat îngustează TEVS, ducând la producerea de gradienți de presiune dinamică (principiul lui Bernoulli). La majoritatea pacienților este prezentă regurgitarea mitrală[14].

Studiile au arătat o creștere a lungimii cuspelor VM (Fig.8) și a ariei acestora în CMHO[15,16], această modificare favorizând SAM. Modificarea zonei de coaptare – ce nu mai are loc la nivelul marginii libere ci la nivelul corpului cuspelor, relaxarea cordajelor tendinoase datorită hipertrofiei mușchilor papilari, sunt mecanisme care conduc la regurgitare mitrală[17, 18].
Fiziopatologia care contribuie la obstrucția TEVS (Fig.9) este complexă și include anomalii interconectate precum hipertrofia asimetrică a VS, SAM, hipertrofia mușchilor papilari cu sau fără deplasarea acestora, inserții anormale ale mușchilor papilari, cât și modificări la nivelul cuspelor VM[5,6].
Deși obstrucția dinamică a TEVS este comună la pacienții cu CMH, aceasta apare și în alte condiții, cum ar fi calcificarea inelului mitral posterior, hipertensiunea arterială, stările hipovolemice și hipercontractile.
Este important să se facă distincția între CMHO și forma non-obstructivă, deoarece strategiile terapeutice sunt în mare parte dependente de prezența sau absența fenomenelor obstructive. Ecocardiografia 2D și cea Doppler sunt de obicei fiabile pentru a determina gradul obstrucției din TEVS și mecanismul prin care obstrucția se produce, dar când imaginile transtoracice nu sunt de calitate se recomandă luarea în considerare a evaluării imagistice prin ecocardiografie transesofagiană (ETE) sau tehnici de imagistică prin rezonanță magnetică.
Bibliografie
- Maron MS. Clinical utility of cardiovascular magnetic resonance in hypertrophic cardiomyopathy. J Cardiovasc Magn Reson 2012;14:13.
- Sherrid MV, Arabadjian M. Echocardiography to individualize treatment for hypertrophic cardiomyopathy. Prog Cardiovasc Dis 2012; 54:461-76.
- Sherrid MV, Chaudhry FA, Swistel DG. Obstructive hypertrophic cardiomyopathy: Echocardiography, pathophysiology, and the continuing evolution of surgery for obstruction. Ann Thorac Surg 2003; 75:620-32.
- Minakata K, Dearani JA, Nishimura RA, Maron BJ, Danielson GK. Extended septal myectomy for hypertrophic obstructive cardiomyopathy with anomalous mitral papillary muscles or chordae. J Thorac Cardiovasc Surg 2004; 127:481-9.
- Kwon DH, Setser RM, Thamilarasan M, Popovic ZV, Smedira NG, Schoenhagen P, et al. Abnormal papillary muscle morphology is independently associated with increased left ventricular outflow tract obstruction in hypertrophic cardiomyopathy. Heart 2008; 94:1295-301.
- Klues HG, Roberts WC, Maron BJ. Anomalous insertion of papillary muscle directly into anterior mitral leaflet in hypertrophic cardiomyopathy. Significance in producing left ventricular outflow obstruction. Circulation 1991; 84:1188-97.
- Ferrazzi P, Spirito P, Iacovoni A, Calabrese A, Migliorati K, Simon C et al. Transaortic chordal cutting: mitral valve repair for obstructive hypertrophic cardiomyopathy with mild septal hypertrophy. J Am Coll Cardiol. 2015; 66: 1687-99.
- G C Rosenquist, E B Clark, L J Sweeney, H A McAllister.The normal spectrum of mitral and aortic valve discontinuity. 1976, 54 (2), 298-301.
- Ferrazzi P, Spirito P, Binaco I, et al. Congenital Muscular Mitral-Aortic Discontinuity Identified in Patients With Obstructive Hypertrophic Cardiomyopathy. J Am Coll Cardiol. 2020;76(19):2238-2247.
- Cavalcante JL, Barboza JS, Lever HM. Diversity of mitral valve abnormalities in obstructive hypertrophic cardiomyopathy. Prog Cardiovasc Dis 2012; 54:517-22.
- Maron BJ, Harding AM, Spirito P, Roberts WC, Waller BF. Systolic anterior motion of the posterior mitral leaflet: A previously unrecognized cause of dynamic subaortic obstruction in patients with hypertrophic cardiomyopathy. Circulation 1983; 68:282-93.
- Sherrid MV, Balaram S, Kim B, Axel L, Swistel DG. The Mitral Valve in Obstructive Hypertrophic Cardiomyopathy: A Test in Context. J Am Coll Cardiol. 2016 Apr 19;67(15):1846-1858.
- Rowin EJ, Maron BJ, Lesser JR, Rastegar H, Maron MS. Papillary muscle insertion directly into the anterior mitral leaflet in hypertrophic cardiomyopathy, its identification and cause of outflow obstruction by cardiac magnetic resonance imaging, and its surgical management. Am J Cardiol. 2013 Jun 1;111(11):1677-9.
- Hong JH, Schaf HV F, Rick A.Nishimura, Martin D.Abel, Joseph A.Dearani, ZhuoLi, Steve R.Ommen. Mitral Regurgitation in Patients With Hypertrophic Obstructive Cardiomyopathy: Implications for Concomitant Valve Procedures. J Am Coll Cardiol. Volume 68, Issue 14, 4. 2016, P 1497-504.
- Moro E, ten Cate FJ, Leonard JJ, Hugenholtz PG, Roelandt J. Genesis of systolic anterior motion of the mitral valve in hypertrophic cardiomyopathy: an anatomical or dynamic event? Eur Heart J 1987; 8:1312–21.
- Klues HG, Maron BJ, Dollar AL, Roberts WC. Diversity of structural mitral valve alterations in hypertrophic cardiomyopathy. Circulation 1992; 85:1651–60.
- DeGregorio C. Refined Echocardiographic Assessment and Contemporary Medical Treatment of Obstructive Hypertrophic Cardiomyopathy Cardiovascular & Haematological Disorders-Drug Targets. Bentham Science Publishers Ltd .2007, 7, 174-187.
- DeGregorio, C. Left ventricular dynamic obstruction by atypical papillary muscle morphology: Is this finding so unusual in clinical practice? J. Am. Soc. Echocardiogr., 2007, 20, 100-1.
- Dorobanțu FL, Spirito P, Căldăraru C, Alexandrescu M, Jurcuț R, Popescu BA, et al. Contemporary management of obstructive hypertrophic cardiomyopathy: Focus on technical advances in surgical myectomy. Romanian Journal of Cardiology. 2016.Vol. 26, No. 3. P 255-62.
 Prof. Univ. Dr. Lucian Dorobanțu
Prof. Univ. Dr. Lucian Dorobanțu