Abstract. Approximately one in 20 chronic heart failure patients progresses to the terminal stage annually, a number that is expected to rise in the next decades. Advanced heart failure patients face grim prognoses and declining quality of life. While cardiac transplantation remains the gold standard, a growing gap between waiting-list patients and donor hearts persists. Recent progress in interspecies models has sparked interest in xenotransplantation as a solution to the organ shortage. Current genetic editing and immunotherapy advances led to 2 successful pig-to-human heart transplants, igniting hope for xenotransplantation. Challenges include managing rejection, toxicity, and regulatory and ethical issues. Clinical studies are required to compare long-term outcomes to current alternatives, but these instances serve as compelling evidence that the point at which xenotransplantation will effectively alleviate the organ donor shortage is now within closer reach than ever before.
Cu o prevalență de aproximativ 64 milioane de cazuri în întreaga lume, insuficiența cardiacă reprezintă una dintre cele mai mari provocări de natură medicală, socială și economică cu care se confruntă umanitatea. Insuficiența cardiacă este cel mai frecvent întâlnită în rândul vârstnicilor, afectând 4,3% din persoanele cu vârste cuprinse între 65 și 70 de ani. Această prevalență este proiectată să crească treptat până în anul 2030, când se estimează că insuficiența cardiacă ar putea afecta până la 8,5% din populație. Ea este adesea asociată cu sindroamele geriatrice, care includ o încărcătură semnificativă de morbiditate și fragilitate, amplificând considerabil impactul acestei afecțiuni. Prevalența insuficienței cardiace când este evaluată prin screening ecocardiografic sistematic ajunge la 11,8%.
Se estimează că unul din 20 de pacienți cu insuficiență cardiacă cronică progresează către stadiul terminal al bolii în fiecare an, iar această proporție este anticipată să înregistreze o creștere însemnată pe măsură ce terapia farmacologică de ultimă generație continuă să extindă considerabil durata de viață a acestor pacienți.
Pacienții ajunși în stadiul avansat al acestei afecțiuni se confruntă cu un prognostic nefavorabil și o dramatică scădere a calității vieții. Transplantul cardiac rămâne opțiunea terapeutică de referință, având o rată de supraviețuire de aproximativ 90% în primul an și o medie de supraviețuire de 12,5 ani.

Deși Societatea Internațională pentru Transplantul de Inimă și Plămân (ISHLT) a raportat o creștere continuă a numărului de transplanturi efectuate la nivel mondial în ultimul deceniu, activitatea de transplant cardiac rămâne suboptimală, principala problemă fiind reprezentată de discrepanța dintre numărul tot mai mare de pacienți aflați pe lista de așteptare și numărul de inimi donate disponibile.
În prezent, numărul transplanturilor de cord este de sub 6.000 de intervenții anual la nivel global, în timp ce numărul implanturilor de dispozitive de asistență ventriculară este de sub 3.500 de unități anual. Este important de menționat faptul că terapia cu dispozitive de asistență ventriculară rămâne inaccesibilă atât în țările în curs de dezvoltare, cât și în țările dezvoltate, în special pentru anumite categorii socioeconomice.
Progresele înregistrate în modelele experimentale care implică interacțiuni între specii au generat premise favorabile pentru introducerea utilizării clinice a xenotransplantului ca posibilă soluție la problema globală a penuriei de organe donate.
Xenotransplantul are o istorie care se întinde pe mai multe secole. Conceptul de xenotransplant uman își are originea în anul 1667, când Jean-Baptiste Denys a efectuat transfuzii de sânge de la animale de fermă la oameni. Acesta a evoluat ulterior cu xenogrefe cutanate provenite de la iepuri, câini și chiar porumbei în secolul al XIX-lea. De asemenea, s-au realizat încercări repetate de implantare de rinichi porcin, de iepure și de capră la pacienții cu insuficiență renală. În anii 1960, Keith Reemtsma a efectuat 13 transplanturi de rinichi de la cimpanzei la oameni în timpul mandatului său la Universitatea Tulane, iar unul dintre pacienți a supraviețuit 9 luni. Această alegere a primatelelor nonumane ca donatori s-a bazat pe relația evolutivă strânsă cu specia umană. Cu toate acestea, majoritatea pacienților au decedat în termen de zile sau luni de la intervenție. În 1964, James Hardy a efectuat primul xenotransplant cardiac folosind un donor cimpanzeu, dar pierderea grefei s-a produs în doar 2 ore din cauza respingerii mediate de anticorpi. În 1984, Leonard Bailey de la Universitatea Loma Linda a efectuat cu succes un transplant ortotopic de cord provenit de la un donator babuin la o fetiță născută cu cord stâng hipoplazic. Pacienta a supraviețuit doar 21 de zile, iar decesul a survenit din cauza rejetului. Progrese recente în imunoterapie și tehnologie de editare a genelor din secolul 21 au reînviat ulterior interesul pentru xenotransplantare, când porcinele s-au afirmat ca specie de donatori cu cel mai mare potențial, datorită dimensiunii și anatomiei similare ale cordului, fezabilității modificărilor genetice precise și un risc relativ scăzut de infecții.
 În 2022, un cord porcin modificat genetic, cunoscut sub numele de „UHeart,” a fost transplantat cu succes la un bărbat în vârstă de 57 de ani pe nume David Bennet, fapt ce a deschis perspective promițătoare pentru viitorul xenotransplantării. Însă acesta a supraviețuit doar 60 de zile. Echipa de cercetare a făcut analiza detaliată a secvenței de evenimente care au condus la insuficiența cardiacă, evidențiind faptul că funcția inimii a rămas în parametri normali, până în ziua a 47-a postoperator. A fost frecvent menționată de către echipa medicală starea precară de sănătate și imunosupresia preexistentă xenotransplantului, ce au limitat utilizarea unui regim eficient de prevenire a rejetului. Pacientul s-a dovedit a fi mai vulnerabil la rejetul mediat de anticorpi, al căror dovezi indirecte au fost identificate pe baza analizelor histologice, a colorației imunohistochimice și a analizelor ARN la nivel de celule individuale. Prezența unui virus latent în cordul porcin, numit citomegalovirus porcin, ar fi putut să contribuie la disfuncția transplantului. Activarea acestui virus ar fi putut avea loc după inițierea regimului de tratament antiviral al pacientului, declanșând ulterior o reacție inflamatorie.
În 2022, un cord porcin modificat genetic, cunoscut sub numele de „UHeart,” a fost transplantat cu succes la un bărbat în vârstă de 57 de ani pe nume David Bennet, fapt ce a deschis perspective promițătoare pentru viitorul xenotransplantării. Însă acesta a supraviețuit doar 60 de zile. Echipa de cercetare a făcut analiza detaliată a secvenței de evenimente care au condus la insuficiența cardiacă, evidențiind faptul că funcția inimii a rămas în parametri normali, până în ziua a 47-a postoperator. A fost frecvent menționată de către echipa medicală starea precară de sănătate și imunosupresia preexistentă xenotransplantului, ce au limitat utilizarea unui regim eficient de prevenire a rejetului. Pacientul s-a dovedit a fi mai vulnerabil la rejetul mediat de anticorpi, al căror dovezi indirecte au fost identificate pe baza analizelor histologice, a colorației imunohistochimice și a analizelor ARN la nivel de celule individuale. Prezența unui virus latent în cordul porcin, numit citomegalovirus porcin, ar fi putut să contribuie la disfuncția transplantului. Activarea acestui virus ar fi putut avea loc după inițierea regimului de tratament antiviral al pacientului, declanșând ulterior o reacție inflamatorie.
La mai puțin de un an de la această premieră, Lawrence Faucette în vârstă de 58 de ani, diagnosticat cu o boală cardiacă terminală, a devenit al doilea pacient din lume care a beneficiat de un xenotransplant de cord porcin modificat genetic. Acesta fusese considerat ineligibil pentru un transplant tradițional cu o inimă umană din cauza bolii vasculare periferice și a coagulopatiei preexistente.
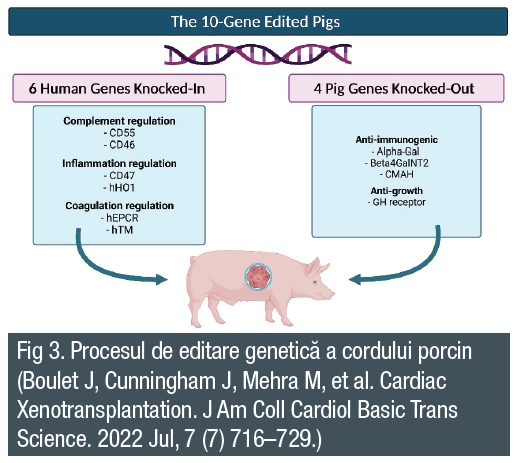
Inima de porc a fost modificată genetic, într-o facilitate biosecurizată a United Therapeutics. Aceasta a fost supusă unei serii de zece modificări genetice pentru a îmbunătăți compatibilitatea xenogrefei cardiace, inclusiv eliminarea a trei xenoantigene imunodominante și introducerea de proteine umane cu rol în reglarea trombozei și reducerea inflamației.
Pentru noua procedură, echipa medicală a implementat măsuri suplimentare de precauție. Echipa de cercetare de la Revivicor a dezvoltat teste noi, caracterizate printr-o sensibilitate crescută, pentru detectarea ADN-ului viral și a anticorpilor împotriva citomegalovirusului porcin.
După o intervenție ce a durat 8 ore, Profesorul Bartley Griffith declara „Încă o dată oferim unui pacient în fază terminală posibilitatea de a-și prelungi durata de viață și suntem deosebit de recunoscători domnului Faucette pentru curajul și dorința sa de a contribui la avansarea cunoștințelor noastre în acest domeniu.”
Cu o experiență mult îmbogățită în urma primului xenotransplant, echipa medicala și- a readaptat strategia, oferind pacientului alături de medicamentele imunosupresoare convenționale, o terapie inovatoare cu un anticorp monoclonal numit Tegoprubart, care blochează CD154, o proteină implicată în activarea sistemului imunitar.
Evoluția post-operatorie a pacientului este una favorabilă, însă este clar pentru toată lumea faptul că supraviețuirea transplantului cardiac xenogen va depinde în mod esențial de managementul problemelor asociate cu respingerea xenogrefei atât umorală și celulară. În plus, sunt esențiale soluționarea problemelor legate de toxicitatea complementului, disfuncția coagulării, disfuncția xenogrefei cardiace perioperatorii și dezvoltarea de medicamente imunosupresoare inovatoare.
Aceste exemple sunt o dovadă clară a faptului că momentul în care xenotransplantul va reuși să rezolve criza de organe donatoare este mai aproape ca niciodată. Succesul în transplantul de inimi porcine în primatele nonumane a fost stimulat în mare parte de tehnologia de editare genetică. Cu toate acestea, traducerea acestor progrese în transplanturi de succes la beneficiari umani ridică noi provocări de natură științifică, reglementară, etică și financiară. Deși xenotransplantul oferă un potențial imens, va fi necesară realizarea unor studii clinice atente pentru a evalua dacă rezultatele pe termen lung rivalizează cu alternativele disponibile în prezent, inclusiv dispozitivele de asistență circulatorie mecanică și utilizarea inimilor umane marginale sau respinse în prezent.
Referințe
- Boulet J, Cunningham J, Mehra M, et al. Cardiac Xenotransplantation. J Am Coll Cardiol Basic Trans Science. 2022 Jul, 7 (7) 716–729.
- Crespo-Leiro M.G., Metra M., Lund L.H., et al. „Advanced heart failure: a position statement of the Heart Failure Association of the European Society of Cardiology”. Eur J Heart Fail 2018;20:11: 1505-1535.
- Fastag E., Varon J., Sternbach G. „Richard Lower: the origins of blood transfusion”. J Emerg Med 2013;44:6: 1146-1150.
- Gibson T. „Zoografting: a curious chapter in the history of plastic surgery”. Br J Plast Surg 1955;8:3: 234-242.
- Rose A.G. . Histopathology of Cardiac Xenograft Rejection Heidelberg, Germany: Springer, 1991.
- Hardy J.D., Kurrus F.D., Chavez C.M., et al. „Heart transplantation in man. developmental studies and report of a case”. JAMA 1964;188:1132-1140.
- Bailey L.L., Nehlsen-Cannarella S.L., Concepcion W., Jolley W.B. „Baboon-to-human cardiac xenotransplantation in a neonate”. JAMA 1985;254:23: 3321-3329.
- Murthy R., Bajona P., Bhama J.K., Cooper D.K. „Heart xenotransplantation: historical background, experimental progress, and clinical prospects”. Ann Thorac Surg 2016;101:4: 1605-1613.
- Perkel J.M. „Xenotransplantation makes a comeback”. Nat Biotechnol 2016;34:1: 3-4.
- Mohiuddin M.M., Singh A.K., Corcoran P.C., et al. „Genetically engineered pigs and target-specific immunomodulation provide significant graft survival and hope for clinical cardiac xenotransplantation”. J Thorac Cardiovasc Surg 2014;148:3: 1106-1113.
- Niu D., Wei H.J., Lin L., et al. „Inactivation of porcine endogenous retrovirus in pigs using CRISPR-Cas9”. Science 2017;357:6357: 1303-1307.
- Reardon S. „First pig-to-human heart transplant: what can scientists learn? Nature News”. https://www.nature.com/articles/d41586-022-00111-9.
- Rabin R.C. „Patient in groundbreaking heart transplant dies. The New York Times”. https://www.nytimes.com/2022/03/09/health/heart-transplant-pig-bennett.html.
- Sykes M., Sachs D.H. „Transplanting organs from pigs to humans”. Sci Immunol 2019;4:41: eaau6298.
- McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2021; 42: 3599–3726.
- Crespo-Leiro MG, Metra M, Lund LH, et al. Advanced heart failure: a position statement of the HFA of the ESC. Eur J Heart Fail 2018; 20: 1505–1535
- Costanzo MR, Mills RM, Wynne J. Characteristics of ‘Stage D’ heart failure: Insights from the Acute Decompensated Heart Failure National Registry Longitudinal Module (ADHERE LM). Am Heart J 2008; 155: 339–347
- Groenewegen A, Rutten FH, Mosterd A, Hoes AW. Epidemiology of heart failure. Eur J Heart Fail. 2020;22(8):1342-1356
 Prof. Univ. Dr. Grigore Tinică
Prof. Univ. Dr. Grigore Tinică
