Autori: Manuela Russu1 Profesor universitar, CORNELIUS ANTONESCU2 masterand, Adriana GHELMENE1 Doctorand, Daniela Degeratu23 MD, PhD, Șerban Nastasia1 Șef lucrặri
1 Universitatea de Medicinặ şi Farmacie “Carol Davila”, Bucureşti;
Disciplina de Obstetricặ şi Ginecologie “Dr. I. Cantacuzino”
2 Universitatea Politehnică, Bucureşti
3 Laboratorul de Anatomie Patologicặ “Dr. I. Cantacuzino
Abstract. Breast is a rare location for Mycobacterium tuberculosis (MbT) infection, and it is an actually continuous challenge for medical staff. This paper presents the first registered Romanian case with MbT location in a young women: a chronic primary tubercular breast abscess, non pregnancy related, with periods of apparent healing, and repeated areolar fistula formation. Incidence, risk factors, hypothetic mechanisms of primary/secondary breast MbT infection, microbiological assessment difficulties- related to conventional (smear with special stains as Ziehl Neelsen, and culture on specific solid/liquid/media), reaction, and the most advanced method with nanoparticles,- delivering fast, high accuracy, sensibility, and specificity results, the differentials to pyogenic abscesses, other chronic granulomas, and breast cancer, treatments issues, MbT resistance to drug therapy( mainly rifampin). One recalls the old concept of „therapeutic antitubercular” test, when all other available assessment steps are usefulness.
Key words: tuberculosis, breast abscess, breast granuloma, molecular diagnosis, nanodiagnosis
Introducere
Tuberculoza (TB) – o boală veche, cunoscutặ de peste 5000 î.Hr reprezintă provocare şi povarặ pentru comunitatea sţiinţificặ şi medicalặ contemporanặ, mai ales în perioada infecţiilor virale prin HIV, şi recent prin pandemia Covid 19, care agraveazặ infecţia cu Mycobacterium Tuberculosis (MbT). „Global Tuberculosis Report 2022″ [1] menţioneazặ 26,3 milioane de oameni cu TB şi 1,5 milioane decese în perioada 2015- 2021, o scặdere de 5,9% a mortalitaţii prin MbT pe plan mondial în perioada 2015-2019, cu creşterea deceselor în perioada 2020 – 2022, paralel cu o ratặ scazutặ de cazuri noi- de la peak-ul de 7,1 milioane în 2019 la 5,8 milioane în 2020, cu evidenţierea subdiagnosticặrii MbT în multe ţặri şi teritorii prin focusarea pe COVID-19 [1}, cu neimplinirea proiectelor OMS pe perioada 2018-2025 în privinţa TB [1]. Lipsa unui vaccin eficient real şi pe termen lung,- cum au reuşit sặ aibặ puţine ţặri [1], a oportunitặţilor de diagnostic rapid şi înalt sensibile pe scara largặ a MbT, a apariţiei tulpinilor multirezistente la terapie reprezintặ de asemenea povara contemporanặ [1; 3], care asociate cu venitul redus, subnutriţia, abuzul de alcool şi tutun, tulburặrile imunosupresive, cặlặtoriile şi imigraţia extinse contribuie la globalizarea TB [1; 4], la care se adaugặ alt aspect catastrofic – costurile financiare tot mai ridicate pe plan mondial [1]
Sânul este o localizare rarặ pentru MbT, chiar şi în ţặrile cu TB endemicặ, în Europa raritatea este şi mai mare, iar în Romậnia este primul caz raportat, din ştiinţa autorilor. In cazul din Bucureşti dificultặţile diagnosticului legat de negativitatea testelor microbiologice specifice existente şi “sặrặcia” bacilară pe ţesutul excizat ar fi putut fi depặşite dacặ la momentul 2014/2015 erau disponibile oportunitặţile oferite de nanoparticule [2] şi nu prin vechiul “test terapeutic cu tuberculostatice”, puţin cunoscut actual, la care s-a apelat la Clinica de Ginecologie “Dr I. Cantacuzino” dupặ a patra recurenţặ a abcesului mamar la o pacientặ tânặrặ, nuligestặ, fặrặ alte patologii, dupặ epuizarea tuturor posibilitặţilor de diagnostic etiopatogenic ale momentului.
Prezentarea cazului
ID de 31 ani, caucazianặ, cu studii superioare şi venit mare, cặsặtoritặ, nuligestặ, sub contraceptive orale combinate, fặrặ istoric familial şi personal de TB sau cunoscutặ a avea/avut contact cu persoane cu tuberculozặ, fặrặ chirurgie mamarặ se prezintặ în decembrie 2014 cu retracţie şi inversiune mamelonarặ, roşeatặ şi îngroşare tegumentului ce acoperặ o tumorặ de 2/1 cm, localizatặ în cadranul supero- intern al sânului drept, mobilặ, cu o fistulặ la nivelul areolei, fặrặ adenopatie axilarặ sau latero-cervicalặ, şi cu sânul stâng normal. Examenul sistemic este negativ şi lipsesc simptome precum febra, pierderea ponderalặ şi/sau a apetitului. Pacienta a prezentat anterior trei episoade similare, primul în 2007, cu o fistulặ a abcesului mamar drept, cu culturi sterile pentru germeni aerobi/anaerobi şi ciuperci din materialul purulent.
Investigaţiile hematologice şi biochimice de rutinặ, ca şi prolactina sericặ sunt normale. Testul HIV negativ. Sonografia sânului relevặ îngroşare tegumentarặ, retracţie mamelonarặ, dilataţii ale ductelor terminale, imagine chisticặ de 2,9 cm diametru, prost delimitatặ cu pereţi groşi. [Figura 1].

Figura 1. Sonografia mamarặ: masặ chisticặ, cu pereţi groşi, cu densitate asimetricặ şi heterogenặ
Examenul citologic al puroiului din fistulặ – coloraţie Giemsa aratặ frotiu bogat celular, cu fundal bogat în celule polimorfe, agregate limfo-histiocitare şi celule gigante multinucleate tip Langhans, detritus de fibrinặ, celule epiteliale rare, aspect care a determinat concluzia de granulom mamar inflamator cronic.
Se procedeazặ la incizie-excizie a ţesutului inflamator mamar, cu drenaj larg a cavitặţii restante, cu examene histopatologic şi microbiologice; fặrặ a se înregistra evenimente adverse precum şoc, toxemie în perioada postoperatorie.
În ianuarie 2015 se înregistreazặ a nouặ fistulặ areolarặ la nivel opus inciziei, cu scurgere de material purulent [Figura 2], fặrặ febrặ sau alte simptome generale, aşa cum au lipsit la fiecare din episoadele precedente, sau la consultaţiile medicale.
Toate culturile (germeni, ciuperci) sunt sterile. Examenul microscopic al piesei excizate relevặ rare celule epiteliale scuamoase, limfocite, plasmocite, histiocite, celule gigante multinucleate de tip Langhans şi numeroase vase sanguine. Coloraţia Ziehl Neelsen şi PCR pentru MbT din fragmentele recoltate la intervenţie sunt negative.
Examenul radiologic pulmonar este normal, intradermoreacţia la PPD mặsoarặ 10 mm

Figura 2. Imaginea areolei şi mamelonului sânului drept: cicatricea cu vindecare lentặ dupặ intervenţia chirurgicalặ din decembrie 2014, şi cicatricea alb sidefie veche; fistulă de partea opusặ cu material purulent; mamelon inversat, retractat

Figura 3: Imagini histopatologice (A. Hematoxilinặ – Eozinặ, 40x; B. Hematoxilinặ – Eozinặ, 20x): Leziuni inflamator- granulomatoase/ Infiltrat inflamator cronic bogat, cu multe histiocite (cu aspect epitelioid) şi numeroase celule gigante multinucleate de tip Langhans
În martie 2015 se decide tratament intensiv antituberculos. (TIA) cu trei medicamente : isoniazidặ, rifampicinặ, etambutol. Vizita de control din mai 2015 (dupặ douặ luni de tratament intensiv) aratặ: remisia fistulelor, vindecare cutanatặ, persistenţa inversiunii mamelonare [Figura 4], şi creştere ponderalặ de 2 kg. Pacienta a totalizat nouặ luni de TIA.
Diagnosticul final este de abces mamar tuberculos primitiv non-gestaţional
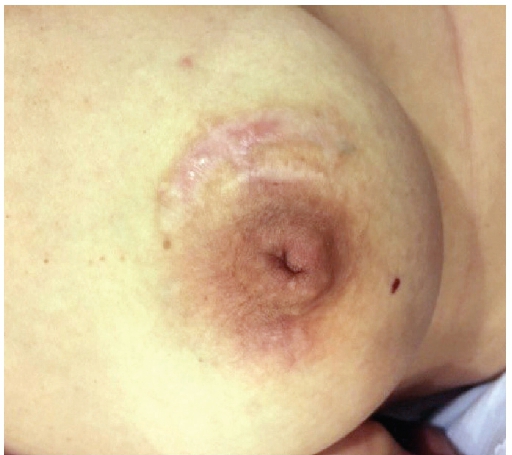
Figura 4. Imaginea sînului drept la 2 luni de TIA. Pacienta în semi-decubit lateral drept, plaga vindecatặ, mamelon inversat, fặrặ sinusuri areolare
Discuţii
Istoria relateazặ cặ Sir Astley Cooper a descris cu numele de “scrofulous swelling of the bosom” primul caz de tuberculozặ mamarặ la o femeie tậnặrặ în anul 1829. TB extrapulmonarặ este raportatặ la aproximativ 18% de cazuri în SUA [5], iar la nivelul sînului este extrem de rarặ în populaţia vesticặ- 0,025 – 0,1% din toate cazurile operate pentru sân. În ultimii 20-25 ani în Europa este extrem de rarặ- 4% în regiunile Europei de Sud (Grecia, Italia, Spania), cu uşoarặ creştere a incidenţei la 8% regiunea Mediteranei de Est (Turcia) [6]. 0,64% pînặ la 3,59% din toate cazurile cu patologie mamarặ sunt în ţặrile în curs de dezvoltare din Asia, Africa, America de Sud, incidenţa cazurilor confirmate histologic fiind de 0,4% anual [7], cu fluctuaţii în Turcia, şi cu cea mai mare incidenţặ în Sudul Turciei [8], India raportậnd TB mamarặ de 5 ori mai rarặ decit carcinoamele [9].

Tabelul 1 prezintặ creşterea incidenţei TB în întreaga lume în ultimii 15-20 ani, când în 2007 s-a înregistrat primul episod în cazul din Romậnia [10]. Implicarea sânului drept sau stâng este aproximativ egalặ (40% vs 44%) [7], bilateralitatea este rarặ [11- 12 ], apặrậnd la 3% din cazuri [13] aşa cum este zona inframamarặ a localizarii TB [14]. MbT afecteazặ sậnul predilect în perioada reproductivặ, 21- 30 ani, fiind un caz raportat în sarcinặ [15], şi rar la prepubertate [16] şi postmenopauzặ [17]. Mastita se descrie atît la femei cît şi la bặrbaţi, în ultimii 20-25 ani [18]. Nici unul dintre factorii de risc recunoscuţi, precum multiparitatea, alaptarea, traumatisme, istoric de mastitặ supuratặ, chirurgie mamarặ reconstructivặ sau introducerea de silicon [19- 20], sau SIDA [17] nu se regặsesc în cazul prezentat.
Prima revedere sistematicặ a studiilor non-analitice asupra TB mamare, publicatặ de European Parliamentary Research Service în cooperare cu OMS şi alte Centre de Control a Bolilor Infecţioase din Europa şi Africa (2019) [21] a înregistrat 1478 cazuri publicate în PubMed, Web of Science, Embase, din 1990 pînặ în martie 2018 în limbile englezặ, francezặ, spaniolặ. Cazul din Romậnia a fost prezentat la Praga (Republica Cehặ) la al XI-lea Congres al Societặţii Europene de Ginecologie (2015) [22].
MbT este un patogen uman intracelular ce infecteazặ gazda, decade fặrặ a determina boala clinic evident, cu reactivare cînd imunitatea este compromisặ; are proprietặţi înnặscute de oprire a maturặrii fagozomilor gazdei şi inhibặrii activặrii macrofagelor, astfel încât se protejeazặ de mecanismele degradặrii şi morţii proprii [23]. Sânul a fost considerat organ rezistent la supraviețuirea şi multiplicarea MbT [24], asemặnặtor splinei, muşchilor striaţi, colului uterin, fapt ce explicặ în parte confuzia cu carcinomul [25], cu abcesele cu germeni piogeni [26], sau cu alte boli [27], mastita tuberculoasặ fiind apreciatặ ca o “mare mascaradặ” (“great masquerader” ) [28]. In contrast cu aceste date, în infecţia sînului cu MbT s-a dovedit cặ sistemul BRCA1/2 este suprimat în timpul infecţiei, ceea ce sugereazặ cặ suprimarea proliferặrii celulare mamare este o caracteristicặ a supravieţuirii b. Koch [29]. Se apreciazặ cặ toate tipurile de Mycobacterium spp şi alţi antigeni/corpi straini (ex. laptele) determinặ o reacţie de hipersensibilitate celularặ puternicặ, implicậnd macrofagele, celulele epitelioide şi gigante, limfocitele Th1 cu citokinele lor, prin activarea cặrora se dezvoltặ granuloamele [30] şi se dezorganizeazặ parenchimul mamar. Enzimele proteolitice distrug reţeaua fibrilarặ de colagen ce susţine structurile sânului, cu formarea de fistule/sinusuri echivalente cu cavernele pulmonare. Granuloamele reprezintặ un mecanism de apặrare faţặ de antigene, care stau în organ farặ sặ fie inactivate, şi deosebit de abcesele pulmonare, MbT sunt foarte reduse cantitativ în granuloamele mamare, unde au şi creştere lentặ [31-32], sau cum apreciazặ alţi cercetặtori MbT sunt distruse prin mecanismele de apặrare ale gazdei [33]. Scurgerea purulentặ abundentặ din fistule se caracterizeazặ printr- un numặr crescut de celule de apặrare şi un numặr redus de MbT, explicînd dificultặţile diagnosticului microbiologic.
Tuberculoza mamarặ este primarặ sau izolatặ, formặ foarte rarặ şi secundarặ tuberculozei pulmonare, sau tuberculozặ extrapulmonarặ. Infecţia primarặ a sânului este prin abraziune sau prin orificiile ductelor de la nivelul mamelonului, situaţie apreciatặ cînd afectarea sânului este singura manifestare, fặrặ alt focar demonstrabil în organism. MbT se rặspîndeşte în sân pe trei cặi – hematogenặ, limfaticặ – via traheobronşic, paratracheal, prin trunchiurile limfatice mediastinale sau ganglionii limfatici mamari interni şi direct, prin contiguitate, de la focarul primar – plamân, pleurặ, coaste, mediastin, articulaţii, şi prin infecţia ductalặ [7 ]. MbT afecteazặ diferit structurile sânului, în raport cu calea de infecţie: epiteliul ductal (primar) sau lobulii (secundar) cu pierderea structurilor acinoase şi distrugerea epiteliului lobular, necroza cazeoasa apare în centrul leziunii, mecanismele distructive progresînd şi afecteazặ şi tegumentele, ce se ulcereazặ şi apare fistula/sinusurile. Refacerea sânului se face prin exces de ţesut fibros, dens.
În Romậnia infecţia tuberculoasặ este mai frecvent secundarặ celei pulmonare, ca şi în ţặrile unde este endemicặ, iar în raport cu capacitặţile noastre de evaluare, cazul din Bucureşti în opinia autorilor a prezentat tuberculozặ primarặ a sînului, infectându-se cu MbT în urmặ cu cîţiva ani, în timpul unui drum lung cu avionul, când a prezentat primul episod inflamator mamar (2007). Excesul de cặlặtorii pare a fi responsabil de globalizarea bolii [4], aceasta a fost explicaţia pentru tuberculoza primarặ a unui barbat de 44 ani, de origine lituanianặ trặind în UK [18 ].
Clinica TB mamare este variabila şi înşelặtoare legat de simptome şi semne: tumoră durặ nedureroasặ – în aproximativ 60% cazuri [34], tumefierea sânului – 48,1% cazuri [9], multiple tumori sunt rar descoperite, cu margini prost delimitate şi aderente la tegumente, chiar la peretele toracic [35] durerea poate apare la unele paciente [36- 37], unii autori descoperind-o la 18,5% cazuri [9]. Aceste date impun diagnostic diferenţial cu carcinomul [35], dar acesta este sugerat de prezenta unei mase mamare tumorale izolate, uneori cu tegumente în “coajặ de portocalặ” prin fixarea tumoralặ, fặrặ traiectele fistuloase de la abces unic sau multiple [38], mamelon retractat sau inversat, hiperpigmentat, cu decolorare focalặ – când boala are lungặ duratặ [35], cu modificặri de formặ şi dimensiuni ale sânului, cu adenopatie axilarặ – în 1/3 cazuri [39]. Simptome precum febra, pierderea ponderalặ, transpiraţiile nocturne, alterarea stặrii generale sunt rareori prezente [31; 40], la fel cum sunt minim influenţate analizele hematologice şi biochimice [31; 40].
Diagnosticul TB este dificil în întreaga lume, identificarea bacililor acido-alcoolo-rezistenţi în ţesutul infectat reprezintặ standardul de aur, realizabil prin metode convenţionale, imunologice şi prin tehnici moderne.
Ţesutul mamar infectat poate fi recoltat prin aspiraţie citologicặ cu ac fin (ACAF) prin core biopsie ţintitặ cu acul/excizie biopsie, şi prin mastectomie, foarte rar. În cazul prezentat MbT s-a cercetat prin tehnici convenţionale şi de diagnostic molecular a puroiului din fistula areolarặ şi a ţesutului mamar extirpat. Sunt bine cunoscute dificultặţile pentru pozitivarea coloraţiei Ziehl- Neelsen (înalt specificặ, cu sensibilitate micặ) sau a culturilor pentru BK [31; 36 ; 41], fiind necesar un numặr mare de MbT pe frotiu ( > 10.000 bacili/mL), şi a creşterii bacilare lente, fapte ce explicặ şi tergiversarea tratamentului specific. Tehnici alternative coloraţiei Ziehl- Neelsen sunt tehnicile de fluorescenţặ cu auraminặ/auraminặ-rhodaminặ [42], care mai recent s-a asociat examinặrii cu imersie de mare putere (x 600) [31] pentru identificarea mai uşoarặ a MbT.
Fragmentele de biopsie pot fi cultivate pe medii pe bazặ de ou, precum Löwenstein-Jensen şi Ogawa, la temperatura camerei, ce evidenţiazặ dupặ 2-4 sặptặmâni coloniile de mycobacterii colorate în galben, sau pe mediu de agar precum Middlebrook 7H10, şi Middlebrook 7H11 ce necesitặ pînặ la 60 zile de aşteptare a rezultatului. Sistemul automat de culturặ cum este Mycobacterial Growth Indicator Tube (MGIT) 960 sistem, recomandat de OMS (2018) [6] ca mediu lichid de culturặ şi ca test de susceptibilitate terapeuticặ, este mai bun decît mediile solide de culturặ şi reduce timpul de aşteptare la 42 zile pentru detecţia MbT [43- 44], existậnd în ultimii 20 ani numeroase asemenea teste comerciale, disponibile în Bucureşti în centrele de diagnostic a bolii pulmonare. Alt aspect al diagnosticului pozitiv este cel legat de recomandarea examinặrii a minim douặ blocuri de ţesut patologic biopsiat/excizat, datoritặ caracterului paucibacilar al leziunilor [33]. Se mai raporteazặ posibila asociere a Staphylococcus aureus şi MbT în culturile din fistulặ [45].
Testặrile imunologice actuale sunt deosebit de utile şi pentru identificarea infecţiei MbT, fiind numeroase rặspunsuri ale gazdei la antigenele tuberculoase [46]. Existặ 2 categorii de asemenea teste ce identificặ anticorpii, comercializate sub 2 forme:
1) Enzyme-Linked Immunosorbent Assay (ELISA) – dedicat depistặrii TB active şi un test rapid, folosit ca point-of-care (POC), ce identificặ MPT64, o fracţie proteicặ înalt specificặ secretatặ de MbT în timpul culturii;
2) depistarea rặspunsului imun celular şi infecţia latentặ: testul cutanat la tuberculinặ (TCT) sau PPD sau Mantoux şi testul IGRA (Interferon N-Gamma Release Assay), o variantặ in vitro a TCT. Doua tipuri de IGRA sunt disponibile în Australia, SUA şi Europa: T- SPOT. TB© assay (Oxford Immunotec, Abingdon, UK), şi QuantiFERON-TB© Gold In-Tube (QFT-GIT) assay (Cellestis Ltd., Vic., Australia), ultimul disponibil şi în Romậnia. Ambele teste sunt aprobate de FDA (SUA) [47- 49].
Literatura medicalặ relevặ limitặrile testelor serologice în formele active ale TB, o sensibilitate redusặ şi a activặrii la unele Mycobacterii non-TB [50].
Un grup de experţi OMS a recomandat evitarea testelor serologice în diagnosticul bolii pulmonare şi extrapulmonare [51], mai ales în ţặri cu venit mic şi mediu, fapt susţinut de cercetặtorii din Marea Britanie, Canada, SUA [48], care au susţinut cặ testele serologice, atît TCT cît şi IGRA, mult utilizate în ţặrile cu boalặ endemicặ nu au acurateţea doritặ, nu fac distincţia între boala latentặ şi activặ, nu îmbunặtặţesc prognosticul [52], Valoarea de 10 mm a testului cutanat la pacienta din Romậnia a fost la limita confirmặrii TB
Testele moleculare reprezintặ obiectul noilor metode de diagnostic a MbT de mai mulţi ani şi prin nuclear acid amplification (NAA), adicặ prin Polymerase Chain Reaction (PCR) se atinge mai uşor acest obiectiv, identificând ADN sau ARN MbT direct din materialul recoltat, în timp mai scurt decît apare rezultatul culturilor [53]. FDA (SUA) le-a acceptat din anul 2000 pentru localizặrile pulmonare şi extrapulmonare.
NAAT se recomandặ cînd frotiul este negativ, dar sunt suspiciuni mari clinice, când zona de provenienţặ a cazului este endemicặ. NAAT detecteazặ MbT în decurs de ore pînặ la cîteva zile faţặ de cultură, şi creşte calitatea programelor de control a bolii. Aceste teste sunt fabricate în SUA [test direct (E-MTD tuberculosis; Gen-Probe, San Diego, CA), Xpert MTB/Rif assay (Cepheid, Sunnyvale, CA, USA, un test automat recomandat şi de OMS], sau în Europa [Amplicor MbT Test (Amplicor; Roche Diagnostic Systems, Inc., Branchburg, Olanda), Line Probe Assays (LPA); INNO-LiPA Rif.TB (Innogenetics, Zwijndrecht, Belgia), Genotype MTBDR/MTBD Rplus and Genotype MTBDRsl (Hain Lifescience, GmbH, Germania)] recunoscute de European Centre for Disease Prevention and Control [54] şi folosite în Romậnia în diagnosticul molecular al bolii pulmonare, şi pentru rezistenţa la terapie. Testul Xpert MTB/Rif assay, propus de OMS face diagnosticul în aceeaşi zi, dar costul şi slaba capacitate de detecţie a bolii extrapulmonare motiveazặ specialiştii sặ caute teste mai ieftine, aşa cum sunt în prezent noile nanotehnologii [2]
Specificitatea şi sensibilitatea metodelor de diagnostic sunt controversate în raport cu localizarea MbT– respiratorie vs extrapulmonarặ [55]. Se comparặ valoarea depistặrii MbT prin PCR real time din sputặ şi pe fragmentele tisulare extrapulmonare fixate în formol/parafinặ cu examenul histologic, standardul de aur al diagnosticului [56- 57]. PCR real time pe fragmentele tisulare fixate în parafinặ are specificitate pînặ la 99%, cu sensibilitate de numai 65% pentru sân comparativ cu peste 90% pentru lichidul cefalo-rahidian, urinặ sau lichidul de spặlặturặ bronho – alveloarặ, la care specificitatea este la fel de mare [58- 59].
Interesul autorilor pentru NAAT a fost legat de diagnosticul diferenţial cu mastita granulomatoasặ [13; 32; 60]. PCR pe fragmentele de sân fixate în parafinặ a fost negativ în cazul prezentat, unii cercetặtori considerînd cặ testele moleculare nu sunt relevante întotdeauna pentru diagnostic, mai ales când frotiul este negativ [32; 61- 62]. PCR real time pentru MbT este folositoare dacặ se pozitiveazặ, dar dacặ este negativặ nu exclude posibilitatea infecţiei [32]. TB mamarặ este paucibacilarặ şi în consecinţặ testele precum microscopia, culturile pe diferite medii speciale, tehnicile PCR nu au aceeaşi valoare de diagnostic cum au în TB pulmonarặ [47]. Negativitatea PCR are mai multe explicaţii: fie moartea BK sau îndepặrtatea prin reacţiile de apặrare ale gazdei – opinie mai veche [33], sau prin existenţa unei infecţii non-tuberculoase cu Corynebacterium spp [63] sau cu mycobacterii non- tuberculoase, care în prezent sunt mai frecvente decît cele tuberculoase în Europa de Vest şi neidentificate prin testul molecular.
În Romậnia anului 2015 nu era posibilặ recomandarea nanoparticulelor (NP) cu proprietặţile lor unice şi particulare, denumite şi “nanoscale molecules” prin dimensiunile de la 1nm la 100nm, precum AUNP/AuNP modificate (NP de aur), silica, NP fluorescente şi NP-magnetice, propuse de aproape 20 ani, fiind în 2017 aproape complet caracterizate 35 de testặri ale TB bazate pe NP [64]. NP marcate sunt alterate prin legarea la cantitặţi minime de biomarkeri sau biomolecule, precum acizii nucleici (gena ADN MbT/secvenţa ADN şi ARN), anticopi, enzime, proteine/peptide (fragmente de MbT) şi dupặ legarea de biomolecule NP acţioneazặ ca “factori” de amplificare a semnalelor electrice/colorimetrice/magnetice ale biomoleculelor. NP sunt recomandate în diagnosticul in vitro/in vivo al BK, fặrặ a modifica proprietặţile colorimetrice ale BK, dar AU schimbặ culoarea cînd este alterat de prezenţa BK. Beneficiile enorme al diagnosticului BK prin NP sunt legate de reproductibilitatea, acurateţea rezultatelor la volume reduse lichide/solide de examinat [65], cu mare sensibilitate şi specificitate, aşa încât pot fi considerate ideale în diagnosticul şi tratamentul TB [66]. Se folosesc dispozitive/platforme simple şi mobile, denumite şi ”laboratoare într-un cip”, de obicei pe bazặ de sticlặ sau silicon, ce permit diagnosticul simultan a numeroase specimene.
Un studiu din Egipt [67] a demonstrat o mare acurateţe a AuNP în detecţia TB din sputặ şi s-a comparat cu combinarea examenului microscopic al frotiului din sputặ (MFS) şi radiografia toracicặ (RxT) (metode convenţionale). Sensibilitatea şi specificitatea testặrii cu AuNP au fost 95% şi respectiv 100%, cu raţia Odd de diagnostic (ORD) de 1053,0, cu aria de sub curbặ (AUC) de 0,975. Testul cu AuNP a avut o performanţặ mai mare decît combinaţia MFS şi RxT; diferenţele între ORD şi AUC au fost de 996,0 şi respectiv 0,125.
Examenul citologic al aspiratului cu ac fin [fine needle aspiration cytology (FNAC)] este o metodặ minim invazivặ de diagnostic a patologiei mamare [68], inclusiv a celei TB. Releveazặ inflamaţia cronicặ granulomatoasặ cu necroza cazeoasặ, şi celulele gigante tip Langhans şi agregatele lifocitice [69- 70], existînd însặ pînặ la 25% din cazuri în care FNAC este negativặ pentru TB [40], deoarece fragmentul tisular prelevat nu este adecvat evaluặrii sau necroza cazeoasặ lipseşte în fragmentul prelevat. Absenţa necrozei cazeoase din fragmentul mamar nu exclude TB, susţinutặ de alte anomalii histologice [71 ]. În aceastặ situaţie se impune excizia/biopsia mamarặ pentru examenul histopatologic [40], ceea ce s-a efectuat în cazul prezentat, dupặ rezultatul negativ al frotiului din puroiul din fistulặ.
În prezent sunt 2 clasificặri histopatologice ale tuberculozei mamare: McKeown KC, Wilkinson KW (1952) [72], cu 5 clase (nodularặ; difuzặ/diseminatặ; sclerozantặ; mastitta tuberculoasặ obliterans; mastitta tuberculoasặ acutặ miliarặ) şi o clasificare indianặ nouặ -Tewari M, Shukla HS (2005) [9] cu 3 clase (nodulo-cazeoasặ; diseminatặ/confluentặ; abces mamar tuberculos). Sunt controverse asupra “mastitei granulomatoase” ce se diagnosticheazặ la femei în perioada reproductivặ, de regulặ multipare la începutul anilor 30 de viatặ, de cele mai multe ori apreciate ca tuberculoză sau cancer [73 ], cu culturi negative pentru MbT, dar cu dovezi clare citologice şi imunocitochimice pentru diagnosticul diferenţial cu tuberculoza mamarặ la FNAC [74] la intervenţia chirurgicalặ. Modificặrile histopatologice induse în sân de MbT, fac diferenţa de alte patologii mamare, precum mastita granulomatoasặ idiopaticặ, o altặ formặ consideratặ “mascaradặ” [28; 72]. Tuberculoza este consideratặ uneori o formặ de “mastitặ granulomatoasặ” secundarặ infecţiei MbT, unii autori folosesc însặ denumirea de “mastitặ granulomatoasặ” celei de “mastitặ granulomatoasặ idiopaticặ”, o entitate inflamatorie cronicặ [75]. Granulomul este un mecanism de apặrare faţặ de antigene, care persistặ în multe organe fặrặ inactivare, leziunile granulomatoase fiind clasificate ca inflamatorii-infecţioase, vasculitice, imunologice, chimice şi neoplazice [30], sau dupặ clasificarea recentă în infecţioase şi non-infecţioase, cu dovada noilor studii cặ microrganismele patogene sunt suspectate a fi cauza bolii granulomatoase non-inflamatorii [76].
“Mastita granulomatoasặ” are etiologie neclarặ, fiind postulaţi factori autoimuni [77], sarcoidoza, necroza grasoasặ, microorganism nedetectate (blastomicoza, actinomicoza, criptococcoza, histoplasmoza, filarioza, corynebacterium), granulomatoza Wegener, ectazia ductalặ, contraceptivele orale; ultimele 2 situaţii fiind prezente în cazul din Bucureşti. “Mastita granulomatoasặ” a fost primul diagnostic la începutul evaluặrii şi acesta este şi parţial o cauzặ a întậrzierii diagnosticului şi tratamentul specific administrat cu întậrziere, aşa cum se descrie şi în alte cazuri în ultimii 30 ani [13]. Tuberculoza mamarặ şi mastita granulomatoasặ “idiopaticặ” sunt considerate “mascaradặ/mascặ” [28 ] sau “imitator” [60].
Unele descoperiri histopatologice [78; 79; 80] fac deosebirea între mastita granulomatoasặ “idiopaticặ” descrisặ prima datặ de Kessler E, Wolloc Y (1972) [81] şi tuberculozặ. MbT afecteazặ toate structurile mamare – grặsime, lobuli, ducte. Granulomul tuberculos se asociazặ cu necroza cazeoasặ, ce determinặ şi numele de “granuloma cazeos” şi îl deosebeşte de mastita granulomatoasặ “idiopaticặ” [31; 82], care mai este denumitặ şi “granulom lobular non-cazeos”. Izolarea MbT în necroza centralặ creşte sensibilitatea diagnosticului, ceea ce nu a fost posibil în cazul prezentat.
Anatomopatologii descriu multe tipuri de granuloame “necrozante”, unele cu inflamaţie-infecţie şi pozitivitate la anumite coloraţii (precum Ziehl- Neelsen sau Grocott Methamine Silver), şi/sau culturi, şi unele cu inflamaţie-infecţie dar fặrặ infecţie cum sunt granulomatoza Wegener, nodulii reumatoizi, granulomatoza necrozantặ sarcoidặ, granulomatoza limfomatoidặ, [32] tipul de celule, aspectul şi conţinutul vaselor pot ajuta diagnosticul. Granulomul din cazul prezentat are numeroase vase normale, ceea ce face diferenţa cu granulomatoza Wegener. Aubry MC (2012) [32] apreciazặ cặ nu o singurặ trặsặturặ histologicặ face deosebirea granulomatozei necrozante infecţioase de granulomatoza Wegener sau de sarcoidozặ, ci trebuiesc combinate mai multe trặsặturi patologice pentru a stabili diagnosticul specific, ceea ce în cazul din Bucureşti s-a putut realiza prin prezenţa celulelor gigante Langhans şi a agregatelor limfocitice în absenţa necrozei cazeoase, iar în final prin testul “terapeutic”. Revederea sistematicặ [21] a datelor de anatomie patologicặ a ajuns la aceeaşi concluzie cu anatomopatologii indieni – Tewari M, Shukla HS (2008) [9] cặ evaluarea citologicặ/anatomopatologicặ trebuie consideratặ faţặ de rezultatele bacteriologice negative şi sặ se considere valoarea testului “terapeutic” pentru a evita întậrzierea prin teste negative cu repetiţie.
Mamografia nu este un standard de diagnostic şi nu a fost recomandatặ prin dominanţa diagnosticului de inflamaţie cronicặ cu episoade recurente, precum mastita granulomatoasặ sau mastita cu plasmocite. Mamografia ar fi putut arặta pattern-uri nodular, diseminat sau sclerozant [83], cu unele modificặri comune celor entitặţi patologice – de formặ, limitare a masei tumorale mamare, reducerea volumului, îngroşarea tegumentelor supradiacente [84], sau traiectul fistulos ce leagặ densificarea mamarặ la pielea îngroşatặ, puternic sugestive pentru abces mamar tuberculos [34]. Tomografia computerizatặ este utilă, în caz de dubii, la diferenţierea leziunilor primare şi secundare, prin evaluarea bolii pulmonare coexistente sau a continuitặţii leziunilor sânului la peretele toracic sau pleurặ [85].
Sonografia mamarặ este controversatặ, neaducând modificặri specifice [83]: leziunile sunt heterogene, hipoecogene, fie ca mase mamare neregulate sau prost delimitate, de dimensiuni mici de obicei, cu ecouri interne, sau ca leziuni chistice cu pereţi groşi şi cu întặrire posterioarặ a unor mase, asociat formặrii fistulei, cu îngroşarea ligamentelor Cooper şi a ţesutului subcutanat, cum s-a descoperit în cazul prezentat. Se discutặ de o modificare ecograficặ unicặ, puternic sugestivặ pentru TB mamarặ: prezenţa traiectului fistulos ce face legặtura între masa mamarặ prost delimitatặ şi îngroșarea tegumentarặ [16]. Evaluarea Doppler color şi evaluarea spectralặ pot identifica un flux cu pattern monofazic şi rezistenţặ scặzutặ [83]:
Rezonanţa magneticặ nuclearặ poate evidenţia asimetria parenchimului mamar, cu întặrire, micro- abcese şi mase periferice.
TB mamarặ se poate confunda cu cancerul, mai ales la vậrstnice [27- 28; 35; 86], ca o tumorặ izolatặ, prost delimitatặ, neregulatặ, unori durặ, fặrặ traiecte /orificii fistuloase, durerea fiind mai frecvent asociatặ TB decît carcinomului. Implicarea areolei şi mamelonului este mai rarặ în TB, iar fixarea tumorii la tegumente, ca parte a procesului inflamator sau carcinogenetic este în ambele situaţii. Suspiciunea de TB creşte cînd se descoperặ asocierea masei tumorale mamare cu un orificiu sau traiect fistulos, sau o masặ nedureroasặ la o femeie imigratặ dintr-o ţarặ cu TB endemicặ. Coexistenţa unei adenopatii axilare tuberculoase cu un carcinom mamar schimbặ în mod fals stadiul cancerului [87- 88], fiind descrisặ asocierea metastazelor de carcinom mamar cu limfadenita tuberculoasặ [89- 93], iar la postmenopauzặ diagnosticul de TB mamarặ nu exclude carcinomul concomitent [4], situaţie descrisặ din 1897 de autorii francezi Pilliet şi Piatot, citaţi de Miller RE, Salomon PF, West JP (1971) [94]. Orificiile şi traiectele fistuloase asociate unei tumori mamare impun diagnosticul diferenţial şi cu actinomicoza (dar lipsesc granulele sulfuroase din puroi) şi cu infecţiile fungice [95], culturile pentru fungi fiind negative la ID.
Literatura semnaleazặ şi alte confuzii de diagnostic: mastita granulomatoasặ “idiopaticặ” sau mastita cu plasmocite, care mimeazặ histopatologic TB mamarặ (prin prezenţa celulelor gigante de corp strặin, a celulelor epitelioide aranjate în tuberculi, alặturi de plasmocite, polimorfonucleare şi limfocite şi celule spumoase macrofage, dar lipsa necrozei cazeoase face diferenţa cu TB) [96 ], mastita lupicặ [97], eritemul nodos [98]. În ultimii ani s-au descris numeroase abcese mamare recurente prin mycobacterii non-tuberculoase [20; 99], avînd manifestặri clinice similar granuloamelor.
În cazurile de TB pulmonarặ şi extrapulmonarặ cu probe PCR negative pentru MbT, sau când este imposibilặ folosirea testelor moleculare moderne NNA pentru detecţia ADN sau ARN–ului mycobacterian direct din produsul analizat, sau nu existặ posibilitatea de nanodiagnostic, ne putem orienta empiric spre terapia anti-tuberculoasặ. Aceastặ atitudine este eficace în absenţa unor teste pozitive, cu suspiciune ridicatặ de TB, sau când mastita granulomatoasặ “idiopaticặ” nu rặspunde la metotrexat sau corticosteroizi [73; 100-101], aşa cum se recunoaşte în prima revedere sistematicặ asupra tuberculozei mamare la femeie [21 ].

Tabelul 2 prezintặ acordul cercetặtorilor asupra diferitelor metode disponibile în diagnosticul TB, cu excepţia nanoparticulelor, care nu s-au recomandat la 1458 cazuri de femei cu TB mamarặ în întreaga lume între 1990 şi martie 2018, publicat în prima revizie sistematicặ [21]. Un index kappa mic şi foarte mic este explicaţia testặrii suspiciune mare de TB şi pentru întârzierea tratamentului.
Când diagnosticul este tardiv sau tratamentul nu este adecvat, mastita tuberculoasặ se complicặ cu abcesul, ce poate penetra în spaţiul retromamar [102- 103] sau la grilajul costal [104], apar orificiile fistuloase, retracţia cu inversiunea mamelonarặ ireversibilặ şi mutilarea mamarặ [26 ], sau recurenţa bolii cu dezorganizare parenchimatoasặ şi mutilare, ceea ce impune drenaj/excizie chirurgicalặ şi uneori mastectomie de “curặţire” cu sau fặrặ sampling ganglionar, cînd diferenţierea de carcinom le impune [102].
Terapia antituberculoasặ (TAT) poate vindeca boala, chirurgia este rar necesarặ, în cazuri rezistente la TAT de ”curặţire” la vârstnice, în cazuri cu mutilarea sânului, sau când histopatologia la “gheațặ” pe fragmentele excizate din tumorặ nu poate face deosebirea de malignitate datoritặ necrozei avansate şi inflamaţiei asociate elementelor granulomatoase [102]. TAT specificặ a fost întârziatặ în cazul prezentat, literatura menţionînd aceasta de multe ori [24]. La momentul înregistrặrii cazului nu existau ghiduri pentru TAT în TB sânului, şi în general se folosesc ghidurile destinate TB pulmonare. Sunt mai multe regimuri terapeutice; de regulặ au o fazặ de tratament intensiv de douặ luni (izoniazidặ, rifampicinặ, pirazinamidặ şi etanbutol), urmat de o fazặ de întreţinere/continuare (izoniazidặ şi rifampicinặ; care este fie scurtặ (7 luni), fie lungặ (9 sau mai mult pînặ la 12-18 luni) în dorinţa reducerii ratei de recurenţặ [95; 105-107], sau o combinaţie a primei linii cu a doua linie de medicaţie antituberculoasặ, pentru a evita riscul tulpinilor multirezistente la tratament [108]. Leziunile mamare se amelioreazặ substanţial dupặ tratamentul intensiv de 2 luni [32]. Tabel 3.

Chirurgia s-a impus în cazul prezentat ca prim pas datoritặ complicaţiilor abcesului în condiţiile diagnosticặrii tardiv a TB. Intervenţia chirurgicalặ a fost minimặ: de drenaj şi excizie-biopsie a pereţilor abcesului. Chirurgia este de regulặ rezervatặ cazurilor selectate, fiind tot mai recomandatặ în ţặrile cu tuberculozặ endemicặ datoritặ rezistenţei la TAT şi distrugerilor tisulare mamare severe [14; 102 ], ce impun mastectomia, mai ales la virstnice.
Concluzii
Tuberculoza trebuie consideratặ în diagnosticul diferenţial al afeciunilor inflamatorii sau tumorale ale sânului din orice parte a lumii, nu numai în ţặrile unde este boalặ endemicặ. Tuberculoza trebuie suspectatặ în boala inflamatorie recurentặ cu analize bacteriologice convenţionale curente negative precum coloraţia Ziehl-Neelsen sau cu teste moleculare ca PCR negative pentru MbT. Examenul histopatologic al biopsiei-exciziei sugereazặ diagnosticul de mastita granulomatoasặ şi celulele gigante multinucleate de tip Langhans certificặ mastita granulomatoasặ tuberculoasặ, chiar în absenţa necrozei cazeaose caracteristice. Ultimul pas în evaluarea mulidisciplinarặ a cazului a fost terapia specificặ antituberculoasặ, care a fost şi un ”Test de Diagnostic al Tuberculozei” mamare şi care poate ajuta la evitarea sau întârzierea mutilặrii sînului. Nanoparticulele sunt promisiunea unei detectặri rapide a tuberculozei pulmonare şi extrapulmonare.
Mulţumiri
Autorii mulţumesc pacientei care a acceptat şi şi-a dat consimtặmîntul prezentặrii cazului
Conflict de interese
Autorii declarặ cặ nu au nici un conflict de interese.
Bibliografie
[1] World Health Organization – Global Tuberculosis Report 2022. Geneva, Switzerland:
[2] Gupta A, Singh A, Singh S – Diagnosis of Tuberculosis: Nanodiagnostics Approaches Nano Bio Mmedicine, 12 Apr. 2020, 261-283
[3] Prezzemolo T, Guggino G, Pio La Manna M, Caccamo N, et al – Functional signatures of human CD4 and CD8 T cell responses to Mycobacterium tuberculosis Front Immunol, 22 April 2014: 5;180.
[4] Bouti K, Soualhi M, Marc K, Zahraoui R, Iraqi G, et al – Postmenopausal Breast Tuberculosis – Report of 4 Cases. Breast Care (Basel). 2012; 7(5):411–13.
[5] Mirsaeidi SM, Masjedi MR, Mansouri SD, Velayati AA- Tuberculosis of the breast: report of 4 clinical cases and literature review. East Mediterr Health J: 2007; 13(3): 670-6.
[6] World Health Organization – Global Tuberculosis Report 2017. Geneva, Switzerland, Oct 30, 2018
[7] Al-Marri MR, Almosleh A, Almoslmani Y. Primary tuberculosis of the breast in Qatar: ten year experience and review of the literature. Eur J Surg; 2000; 166: 687–90
[8] Tanrikulu AC, Abakay A, Abakay O, Kapan M. Breast Tuberculosis in Southeast Turkey: Report of 27 Cases. Breast Care (Basel). 2010; 5(3):154-7.
[9] Tewari M, Shukla HS. Breast tuberculosis: Diagnosis, clinical features, and management. Indian J Med Res. 2005;122:103–10.
[10] Russu M, Nastasia S, Degeratu D, Stanculescu S- Breast and Cervix uteri: Rare locations for Mycobacterium tuberculosis infections and complications. Cases Report and Literature Review. In “Tuberculosis”, Kayembe JM, editor, INTECH Editure, 2018; London, UK
[11] Kant S, Dua R, Goel MM. Bilateral tubercular mastitis: a case report. Lung India, 2007; 24: 90-3
[12] Ruiz- Moreno JL, Peňa- Santos G – Bilateral tuberculous mastitis nulliparous patient, initially treated as idiopathic granulomatous mastitis. Ginecol Obstet Mex 2012; 80 (3):228-31.
[13] Banerjee SN, Ananthakrishnan N, Mehta RB, Parkash S. Tuberculous mastitis: a continuing problem. World J Surg; 1987; 11(1):105-9
[14] Singal R, Bala J, Gupta S, Chawla A, et al. Primary Breast Tuberculosis Presenting as a Lump: A Rare Modern Disease. Ann Med Health Sci Res. 2013; 3(1): 110–2.
[15] Chellaoui M, Taleb A, Chat L, Benamour- Ammar H, et al – Tuberculosis of the breast: a case report. J Radiol. 2002; 83(6 Pt 1): 742-4.
[16] Bani Hani KE, Yaghan RJ, Matalka Il, Mazahrich TS. Tuberculous mastitis: a disease not to be forgotten. Int J Tuberc Lung Dis. 2005;9(8):920-5
[17] Gupta PP, Gupta KB, Yadav RK, Agarwal D – Tuberculous mastitis. A review of seven consecutive cases. Ind J Tub. 2003; 50: 47–50
[18] Brown S, Thekkinkattil KD. Tuberculous cold abscess of breast: an unusual presentation in a male patient. Gland Surg. 2016; 5(3): 361–5.
[19] Rimmer J, Hamilton S, Gault D. Recurrent mycobacterial breast abscesses complicating reconstruction. Br J. Plast. Surg: 2001; 57(7):676-8.
[20] Atallah D, El Kassis N, Veziris N, Sarkis D, et al. Mycobacterial infection of breast prosthesis- a conservative treatment: a case report. BMC Infect Dis 2014; 238;
[21] Quaglio GL, Pizzol D, Isaakidis P, Bortolani A, Tognon A, Marrota C, Di Gennaro F, Putoto G, Ollioro LP. Breast tuberculosis in women. A systematic Review. Amer J Trop Med Hyg. 2019, Jul;101(1):12-21
[22] Russu M, Predescu G, Degeratu D. Recurrent non gestational primary breast abscess due to Mycobacterium tuberculosis infection. An unusual modern entity. Case report. “Book of Abstracts”. 11th Congress of the European Society of Gynecology, 21-24 Oct Prague, Czech Republic, www seg 2015.
[23] Bekale RB, Du Plessis S, Hsu N. et al. Mycobacterium Tuberculosis and Interactions with the host Immune System: Opportunities for Nanoparticle Based Immunotherapeutics and Vaccines. Pharm Res. 2019; 36
[24] Lin TL, Chi SY, Liu JW, Chou FF. Tuberculosis of the breast: 10 years’ experience in one institution. The international journal of tuberculosis and lung disease.Official J IntUnion Tuberculosis Lung Dis. 2010; 14(6): 758-63.
[25] Daryanani A, Sundeep P, Rodrigues G, Kumar S, Kudva R Tuberculosis Mastitis Masquerading As Carcinoma Breast. The Internet Journal of Tropical Medicine. 2002; 1: 1-4
[26] Chowdri NA, Parray FQ, Dar RA, Malik RA, et al Tubercular mastitis– a rare presentation. Int J Surg: 2010;8(5): 398-400.
[27] Morino GF, Rizzardi G, Gobbi F, Baldan M. – Breast tuberculosis mimicking other diseases. Tropical Doctor; 2007; 37(3):177-8.
[28] Gon S, Bhattacharyya A, Majumdar B, Kundu S – Tubercular mastitis a great masquerader. Turk Patoloji Derg. 2013; 29(1):61-3.
[29] Kaewseekhao B, Naranbhai V, Faksri K, et al. Comparative Proteomics of Activated THP-1 – Cells Infected with Mycobacterium tuberculosis Identifies Putative Clearance Bio markers for Tuberculosis Treatment. PloS ONE. 2015; 10(7); e0134168.
[30] James DG. A clinicopathological classification of granulomatous disorders Postgrad Med J. 2000; 76: 457–46
[31] Alzaara A, Dalal N. Co-existence of carcinoma in tuberculosis in one breast. World J Surg Oncol;2008; 6: 29.
[32] Aubry MC. Necrotizing granulomatous inflammation: what does it mean if your special stains are negative? Mod Pathol, 2012; 25 Suppl 1:S31-8.
[33] Ulbright TM, Katzenstein AA. Solitary necrotizing granulomas on the lung.Am Jof Surg.Pathol;1980; 4: 13–28.
[34] Makanjuola D, Murshid K, Al Sulaimani S, Al Saleh M. Mammographic features of breast tuberculosis: the skin bulge and sinus tract sign. Clin Radiol: 1996; 51(5): 354-8.
[35] Maroulis I, Spyropoulos C, Zolota V, Tzorakoleftherakic E. Mammary tuberculosis mimicking breast cancer: a case report. J Med Case Rep; 2008; 2: 34
[36] Harris SH, Khan MA, Khan R, Ansari MM, et al Mammary tuberculosis: analysis of thirty-eight patients. ANZ J. Surg. 2006; 76 (4): 234-7.
[37] Khodabakhshi B, Mehravar F. Breast tuberculosis in northeast Iran: review of 22 cases. BMC Women Health; 2014; 14:72.
[38] Singal R, Dalal AK, Dalal U, Attri AK. Primary Tuberculosis of the Breast Presented as Multiple Discharge Sinuses. Indian J Surg: 2013;75:66–7.
[39] Mehta G, Mittal A, Verma S. Breast tuberculosis- clinical spectrum and management. Indian J Surg. 2010; 72: 433-7.
[40] Akçay MN, Saglam L, Povoski SP, et al. Mammary tuberculosis – importance of recognition and differentiation from that of a breast malignancy: report of three cases and review of the literature. World J Surg Oncol: 2007; 18; 5: 67.
[41] Morsad F, Ghazli M, Boumzgou K, et al. Mammary tuberculosis: a series of 14 cases.J Gynecol Obstet Biol Reprod (Paris) 2001; 30: 331-7.
[42] Woodard BH, Rosenberg SI, Farham R, et al. – Incidence and nature of primary granulomatous inflammation in surgically removed material. Am J SurgPathol; 1982; 6:119–29.
[43] Chihota VN, Grant AD, Fielding K, Ndibongo B, van Zyl A, et al. Liquid vs. solid culture for tuberculosis: performance and cost in a resource-constrained setting. Int J Tuberc Lung Dis Off J Int Union Tuberc Lung Dis. 2010; 14: 1024–31.
[44] Lawson L, Emenyonu N, Abdurrahman ST, Cuevas LE, et al. Comparison of Mycobacterium tuberculosis drug susceptibility using solid and liquid culture in Nigeria. BMC Res Notes.2013; 6: 215.
[45] Tauro LF, Martis JS, Hegde BR, et al. Tuberculous mastitis presenting as breast abscess. Oman Medical Journal; 2011, 26: 53-55
[46] Steingart KR, Dendukuri N, Henry M, Schiller I, Hopewell PC, et al. Performance of purified antigens for serodiagnosis of pulmonary tuberculosis: a meta-analysis. Clin Vaccine Immunol American Society for Microbiology.2009; 16: 260– 76.
[47] Pai M, Riley LW, Colford JM. Interferon-gamma assays in the immunodiagnosis of tuberculosis: a systematic review. Lancet Infect. Dis. 2004; 4:761–76.
[48] Pinto LM, Grenier J, Schumacher SG, Denkinger CM, Steingart KR, Pai M. Immunodiagnosis of Tuberculosis: State of the Art. Medical Principles and Practice.2012; 21(1): 4-13
[49] Lagrange PH, Thangaraj SK, Dayal R, Kumar M, et al. A toolbox for tuberculosis (TB) diagnosis: an Indian multi-centric study (2006–2008); evaluation of serological assays based on PGL-Tb1 and ESAT-6/CFP10 antigens for TB diagnosis. PLoS ONE;2014; 9: e96367
[50] She CR, Litwin MC. Performance of a Tuberculosis Serologic Assay in Various Patient Populations. American Journal of Clinical Pathology, 2015; 144, 240-6
[51] World Health Organization. Global tuberculosis control 2010. Geneva, World Health Organization, 2010
[52] Ra SW, Lyu J, Choi C-M, Oh Y-M, Shim TS, et al. Distinguishing tuberculosis from Mycobacterium avium complex disease using an interferon-gamma release assay. Int J Tuberc Lung Dis Off J Int Union Tuberc Lung Dis. 2011; 15: 635–40
[53] Soini H, Musser JM -Molecular diagnosis of mycobacteria. Clin.Chem: 2001; 47: 809–14.
[54] European Centre for Disease Prevention and Control. ERLN-TB expert opinion on the use of the rapid molecular assays for the diagnosis of tuberculosis and detection of drug-resistance. Stockholm: ECDC. 2013
[55] Wiener RS, Della-Latta P, Schluger NW. Effect of nucleic acid amplification for mycobacterium tuberculosis on clinical decision making in suspected extrapulmonary tuberculosis. Chest; 2005; 128:102–7.
[56] Park DY, Kim JY, Choi KU, Suh KS, et al. Comparison of PCR with histopathologic features for diagnosis of tuberculosis in formalin-fixed, paraffin-embedded histologic specimens. Arch Pathol Lab Med. 2005;127(3):326-30.
[57] Polepole P, Kabwe M, Kasonde M, Bates M, et al – Performance of the Xpert MTB/RIF Assay in the Diagnosis of Tuberculosis in Formalin-Fixed, Paraffin-Embedded Tissues. Int J Mycobacteriol. 2017, 6(1): 87-93.
[58] Buckwalter SP, Wengenack NL Detection of mycobacteria in paraffin-embedded tissue using lightcycler PCR. American Society for Microbiology.104th General Meeting, 23–27 May, 2004; New Orleans, LA.
[59] Nyendak MR, Lewinsohn DA, Lewinsohn DM. New diagnostic methods for tuberculosis. Curr Opin Infect Dis; 2009; 22: 174–82.
[60] Ruiter AM, Vegting IL, Nanayakkara PW. Idiopathic granulomatous mastitis: a great imitator? MBJ Case Report. 2010; 03: 28 – 44
[61] Katoch VM. Newer diagnostic techniques for tuberculosis. Indian J MedRes. 2004;120: 418-28.
[62] Veziris V. Bacteriological diagnosis of tuberculosis. Rev Prat. 2012; 62(4): 490-2
[63] Taylor GB, Paviour SD, Holland DJ, et al. A clinicopathological review of 34 cases of inflammatory breast disease showing an association between corynebacteria infection and granulomatous mastitis. Pathology, 2003; 35:109-19.
[64] El-Samadony H, Althani A, Tageldin MA, Azzazy MEH. Nanodiagnostics for tuberculosis detection. Expert Review of Molecular Diagnostics, 2017, 17 (5), 427-43
[65] Jackson TC, Patani BO, Ekpa DE- Nanotechnology in Diagnosis. A review. AdvNanopart. 2017; 6: 93-102;
[66] Wang Y, Yu L, Kong X, Sun L. Application of nanodiagnostics in point-of-care tests for infectious diseases. Int J Nanomedicine 2017; 12: 4789–803
[67] El-Samadony H, Azzazy MEH, Tageldin MA, Elmaghraby T, et al. Nanogold Assay Improves Accuracy of Conventional TB Diagnosis. Lung; 2019; 197(2): 241-7.
68] Yu YH, Wei W, Liu JL Diagnostic value of fine-needle aspiration biopsy for breast mass: a systematic review and meta-analysis. BMC Cancer 2012; 12: 41.doi: 10.1186/1471-2407-12-41.
[69] Kakkar S, Kapila K, Singh MK, Verma K. Tuberculosis of the breast. A cytomorphologic study. Acta Cytol; 2000; 44:292–6.
[70] Mehrota R Fine needle aspiration diagnosis of tuberculous mastitis Indian J. Pathol Microbiol. 2004; 47(3): 377-80.
[71] Jalali U, Rasul S, Khan A, Akhter R, et al. Tuberculous mastitis. J Coll Physicians Surg Pak; 2005; 15: 234–7.
[72] McKeown KC, Wilkinson KW. Tuberculosis of the breast. Br J Surg; 1952; 39: 420-9.
[73] Sriram KB, Moffatt D, Stapledon R Tuberculosis infection of the breast mistaken for granulomatous mastitis: A case report. Cases J; 2008;1: 273
[74] Lacambra M, Thai TA, Lam CC, Tse GM, et al Granulomatous mastitis: the histological differentials . J. Clin. Pathol, 2011; 64: 405 – 11.
[75] Bakaris S, Yuksel M, Ciragil P, Bulbuloglu E, et al. Granulomatous mastitis including breast tuberculosis and idiopathic lobular granulomatous mastitis. Can J Surg, 2006;49 (6): 427 – 30
[76] Inoue Y, Suga M. Granulomatous disease and pathogenic microorganism Kekkaku: 2008; 83(2): 115-30.
[77] Altintoprak F, Karakece E, Kivilcim T, Ciftci IH, et al. Clinical Study. Idiopathic Granulomatous Mastitis: An Autoimmune Disease? Scientific World Journal, 2013; 148727 eCollection 2013 ..
[78] Akcan A, Akyildiz H, Deneme MA, Aritas Y, et al. Granulomatous lobular mastitis: A complex diagnostic and therapeutic problem. World J Surg. 2006; 30: 1403–9.
[79] Baslaim MM, Khayat HA, Al-Amoudi SA. Idiopathic granulomatous mastitis: A heterogeneous disease with variable clinical presentation. World J Surg; 2007; 31: 1677–81
[80] Bahoroon S.Tuberculosis of the breast. Ann Thorac Med. 2008; 3(3): 110–4.
[81] Kessler E, Wolloc Y Granulomatous mastitis: a lesion clinically simulating carcinoma. Am J ClinPathol; 1972; 58: 642-6.
[82] Belaabidia B, Essadki O, el Mansouri A, Squalli S. Idiopathic granulomatous mastitis: apropos of 8 cases and review of the literature. Gynecol Obstet Fertil: 2002; 30(5): 383-9
[83] Kervancioğlu S, Kervancioğlu R, Oźkur A, Sirikçi A. Primary tuberculosis of the breast. Diagn Interv Radiol. 2005; 11(4): 210-2.
[84] Al-Marri MR, Aref E, Omar AJ. Mammographic features of isolated tuberculous mastitis. Saudi Med J. 2005; 26: 646–50
[85] Romero C, Carreira C, Cereceda C, Bolaňos F, et al. Mammary tuberculosis: percutaneous treatment of a mammary tuberculous abscess. Eur Radiol. 2000; 10(3): 531-3.
[86] Khandelwal R, Jam I. Breast tuberculosis mimicking a malignancy falsely over-stage the disease a rare case report with review of literature. Breast Dis. 2013; 34(2): 53-5.
[87] Munjal K, Jain K V, Agrawal A, Bandi KP. Co-existing tubercular axillary lymphadenitis with breast carcinoma can falsely over-stage the disease. Case series. Indian J Tuberc. 2010; 57: 104-7
[88] Aravind TK, Yeswanth N, Monirah Z,Sebu A- “A sheep in a wolf’s clothing” Case Report. Of tubercular axillary limph nodes mimicing metastases in a case of breast carcinoma with brief review of literature. Annals of Research in Oncology, 2022, vol 2(4),259-64
[89] Robinson A, Horne C, Weaver A. Coexistence of axillary tuberculous lymphadenitis with lymph node metastases from a breast carcinoma. Clin Oncol. 2001; 1(3):144 – 147
[90] Fujii T, Kimura M, Yanagita Y, Kuwano H. et al. Tuberculosis of axillary lymph nodes with primary breast cancer. Breast Cancer. 2003; 10: 175–8
[91] Tulasi NR, Raju PC, Damodaran V, Randhika TS. A spectrum of coexistent tuberculosis and carcinoma in the breast and axillary lymph nodes: report of five cases. Breast. 2006; 15(3): 437-9.
[92] Khurram M, Tariq M, Shahid P. Breast cancer with associated granulomatous axillary lymphadenitis: a diagnostic and clinical dilemma in regions with high prevalence of tuberculosis. Pathol Res Pract : 2007; 203(10): 699-704
[93] Bromberg SE, Tenorio de Amaral PG- Tuberculosis axillary limph node coexistent breast cancer in adjuvant treatment, case report .EINSEinstein (Sao Paolo), 2013; 13 (3)
[94] Miller RE, Salomon PF, West JP – The coexistence of carcinoma and tuberculosis of the breast and axillary lymph nodes. Am J Surg ; 1971 Mar;121 (3) 338-40.
[95] Khanna R, Prasanna GV, Gupta P, Khanna AK, et al. Mammary tuberculosis: report on 52 cases. Postgrad Med J. 2002; 78(921): 422–4.
[96] Naragam AP, Tati YS, Dara H. Kawathekar P, et al. Plasma Cell Mastitis mimicking as carcinoma of the breast: A case report and review of the literature IOSR Journal of Dental and Medical Sciences. 2014; 13(2): 28 – 31;
[97] Diallo R, Frevel T, Poremba C, Dockhom- Dworniczak B, et al. Lupus vulgaris as the etiology of tuberculous mastitis. Pathologie.1997; 18(1): 67-70
[98] Kao PT, T u MY, Tang SH, Ma HK.Tuberculosis of the breast with erythema nodosum: a case report. J Med Case Rep. 2010; 4: 124.
[99] Yoo H, Choi SH, Choi SJ, et al. Recurrent bilateral breast abscess due to nontuberculous mycobacterial infection. J Breast Cancer, 2014; 17(3): 295-8.
[100] De Sousa R, Patil R. Breast tuberculosis or granulomatous mastitis: A diagnostic dilemma Ann Trop Med Public Health:2011; 4:122-5.
[101] Sheybani F, Sarvghad M, Naderi HR, Gharib M. Treatment for and clinical characteristics of granulomatous mastitis. ObstetGynecol 2015; 125(4): 801-7.
[102] Marinopoulos S, Lourantou D, Gatzionis T, Antsaklis A, et al – Breast tuberculosis: Diagnosis, management and treatment. Int J Surg Case Reports; 2012: 3(11): 548-50
[103] Yukawa M, Watatani M, Isona S, Inoue M, et al. Management of granulomatous mastitis: a series of 13 patients who were evaluated for treatment without corticosteroids. Int Surg. 2015: 100(5): 774-82.
[104] Challa VR, Srivastava A, Dhar A – Scrofulous swelling of the bosom masquerading as cancer. Indian J Med Microbiol 2014; 32(1): 82-4
[105] O’Reilly M, Patel KR, Cummins R. Tuberculosis of the breast presenting as carcinoma. Mil Med; 2000; 165: 800–2.
[106] Daali M, HssaidaR, Had A Primary tuberculosis of the breast. Presse Med. 2001;30:431–3
[107] Gupta V, Mohan H, Jain P, Singh S, Singla N. Tuberculous Mastitis: A Report of Two Cases in Elderly Females. Jpn J Infect Dis. 2006: 279-80
[108] Kumar P, Sharma N. Primary MDR. Tuberculosis of the breast.Indian J Chest Dis Allied Sci. 2003; 45: 63–5.
 Prof. Univ. Manuela Russu
Prof. Univ. Manuela Russu